Definition der Molekulargeometrie
Verschiedenes / / January 11, 2022
Begriffsdefinition
Es ist die Struktur eines Moleküls, die die dreidimensionale Anordnung der Atome im Raum bestimmt.

Chemieingenieur
Molekülgeometrien werden derzeit auf der Grundlage der Theorie der Repulsion of Electronic Pairs of the Valencia Layer (TRPECV). Diese Theorie ermöglicht die Vorhersage des Verhaltens chemisch von Stoffen (insbesondere kovalent) und hilft beim Verständnis der Verteilung Elektronik, die zu Geometrie des Molekül. Dies wiederum ermöglicht es uns, viele der Eigenschaften zu verstehen, die Stoffe erwerben.
Diese Theorie basiert auf einer Reihe von Grundpfeilern, die wir überprüfen und dann versuchen werden, ihre zu verstehen Anwendung trainieren. In erster Linie werden gebundene und ungebundene (Valenz-)Elektronen als ein Meer von Elektronen betrachtet, das durch besitzen die gleiche Ladungsart, sie stoßen sich gegenseitig ab, sodass sie sich immer so weit vom Zentralatom des Molekül.
Zweitens bildet dieses "Meer" von Elektronen oder "Elektronenwolke" Bereiche mit hoher Elektronendichte, die in Bindungen aufgebaut sind, in denen die Elektronen geteilt werden, oder in Paaren von Elektronen, die nicht geteilt werden. Die gebildeten Bindungen können wiederum Einfach-, Doppel- oder sogar Dreifachbindungen sein.
Schließlich für entscheiden Molekülgeometrie ist es sehr hilfreich, die Lewis-Struktur zu haben, bei der die Menge der Elektronendichten um das Zentralatom herum gezählt wird und dies ergibt Indikation vom Namen seiner Geometrie und der Form, die das Molekül dreidimensional annimmt.
Es ist zu beachten, dass diese Dichten so weit wie möglich auseinander liegen, um eine möglichst stabile Struktur und eine geringere Abstoßung anzunehmen. Auf diese Weise wird zuerst die elektronische Geometrie identifiziert und dann die molekulare Geometrie.
Sechs Dichtestufen
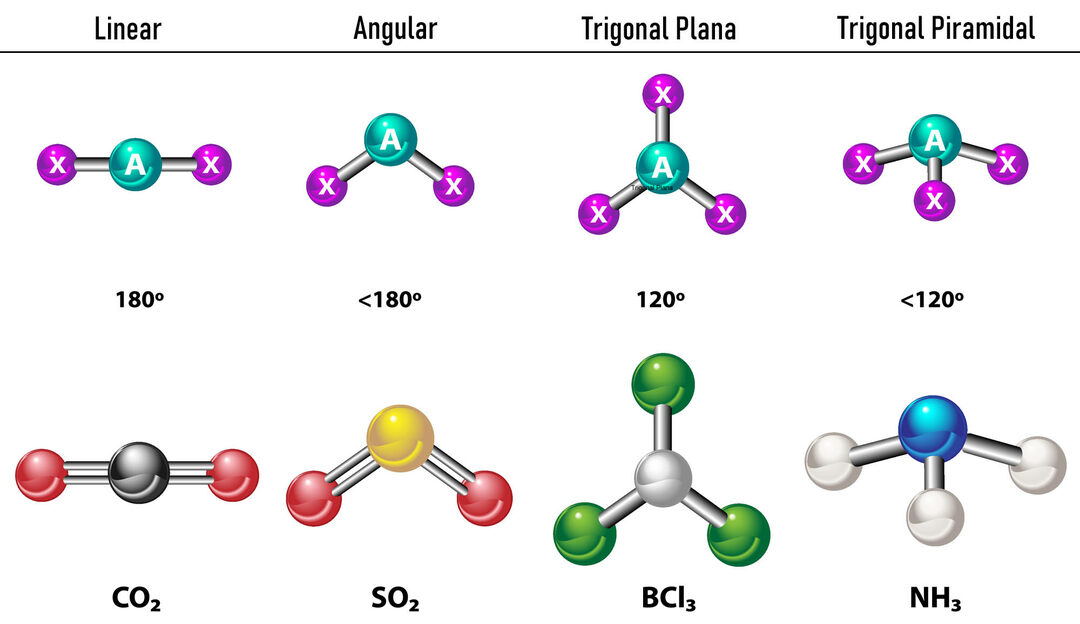
Für den Fall, dass sich um das Zentralatom zwei Elektronendichten befinden, liegen die Bindungen so weit auseinander zwischen ihnen, dh 180º voneinander entfernt, und daher ist ihre elektronische Geometrie linear und molekular auch linear.
Für den Fall, dass es um das Zentralatom drei Elektronendichten gibt, gibt es zwei Möglichkeiten: drei Bindungen oder zwei Bindungen und ein ungebundenes Paar. Bei drei Bindungen ist die elektronische Geometrie Trigonal flach, mit 120°-Winkel zwischen Bindungen und molekularer Geometrie trägt den gleichen Namen. Wenn es nun ein nicht gebundenes Paar gibt, stoßen sie sich gegenseitig mit mehr ab Intensität dass gebundene Ladungen daher dazu neigen, Bindungswinkel zu komprimieren. Der Winkel zwischen dem freien Paar und jeder Bindung beträgt 120° und die elektronische Geometrie ist trigonal, während die molekulare Geometrie eckig ist.
Im Fall von vier Elektronendichten um das Zentralatom ist die elektronische Geometrie tetraedrisch. Wenn alle vier Elektronenpaare gebunden sind, stimmt ihre Molekülgeometrie dem Namen nach mit ihrer elektronischen Geometrie überein und der Bindungswinkel beträgt 109,5°. Wenn nun eines der Paare frei ist, wird der Bindungswinkel kleiner (107º) und die Molekülgeometrie ist Typ Trigonale Pyramide. Wenn schließlich zwei freie Paare sind und zwei gebunden sind, beträgt der Bindungswinkel 104.5º, während die Molekülgeometrie als bezeichnet wird Eckig.
Wenn die Elektronendichten um das Zentralatom fünf betragen, heißt es a Trigonale Bipyramide seine elektronische Geometrie. Wenn alle Lasten verbunden sind, gibt es Winkel von 120°C zwischen den äquatorialen Verbindungen und 90° zwischen den axialen und den äquatorialen. Jetzt wird die molekulare Geometrie auch als trigonale Bipyramide bezeichnet, während die molekulare Geometrie mit vier verbundenen Paaren und einem freien Paar verzerrt ist und die bekannte "Rocker“, Da ist der Name, den es erhält Verzerrter Tetraeder. Sind hingegen zwei der fünf Elektronenpaare frei und drei davon gebunden, hat es eine „T“-förmige Geometrie und seinen Namen verdankt es gerade seiner Struktur. Wenn es schließlich umgekehrt ist, drei freie Paare und zwei gebundene Ladungen, ist die Molekülgeometrie linear.
Schließlich gibt es sechs Elektronendichten um das Zentralatom und ein Oktaeder wird gebildet, daher sein Name in der elektronischen Geometrie. In ähnlicher Weise wird die Molekülgeometrie benannt, wenn alle ihre Paare verknüpft sind. Wenn Sie fünf verbundene Paare und ein freies Paar haben, ist die molekulare Geometrie Quadratbasispyramide. Wenn Sie vier gebundene Paare und zwei freie Paare haben, ist die Molekülgeometrie Quadratische Wohnung.
Abbildung: Süße Natur
Themen der Molekulargeometrie

