20 Beispiele für Amide
Beispiele / / November 06, 2023
Der Amide Sind organische chemische Verbindungen Derivate von Carbonsäuren, bei denen die Hydroxylgruppe (-OH) der Carboxylgruppe (-COOH) der Säure durch eine Aminogruppe (-NH) ersetzt ist2, -NH-R, -N-(R)2, wobei R eine beliebige Kohlenstoffkette ist).
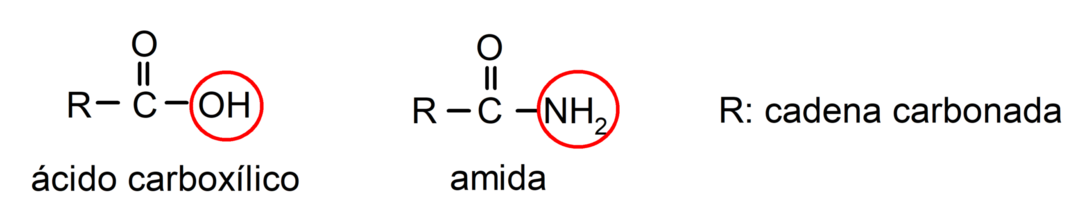
Amide sind organische Moleküle die die Amidgruppe enthalten, die aus einer Carbonylgruppe und einer Aminogruppe besteht. Zum Beispiel: Etanamid, Propanamid und N-Methylethanamid.

- Siehe auch: Aldehyde und Ketone
Arten von Amiden
Amide können nach der Anzahl der Wasserstoffe (die an den Stickstoff der Aminogruppe gebunden sind) klassifiziert werden, die durch verschiedene Substituentengruppen ersetzt wurden. In diesem Sinne gibt es primäre, sekundäre und tertiäre Amide.
- Primäre Amide. Es handelt sich um Amide, bei denen die Wasserstoffe der Aminogruppe nicht substituiert sind. Zum Beispiel:

- Sekundäre Amide. Es handelt sich um Amide, bei denen einer der Wasserstoffatome der Aminogruppe substituiert ist. Zum Beispiel:

- Tertiäre Amide. Es handelt sich um Amide, bei denen zwei der Wasserstoffatome der Aminogruppe substituiert sind. Zum Beispiel:

Nomenklatur der Amide
Gemäß der gängigen Nomenklatur werden Amide als Derivate von Carbonsäuren nach folgenden Regeln benannt:
- Der der Carbonylgruppe entsprechende Kohlenstoff befindet sich in Position 1 und aus diesem Kohlenstoff wird die längste Kohlenstoffkette ausgewählt. Zum Beispiel:

- Primäre Amide werden mit dem Präfix benannt, das der Anzahl der Kohlenstoffatome der Carbonsäure entspricht, aus der sie entstanden sind. Zum Beispiel:

Nach Angaben der International Union of Pure and Applied Chemistry (IUPAC) Amine Die Benennung erfolgt nach folgenden Regeln:
- Sekundäre und tertiäre Amide werden mit dem Präfix benannt, das der Anzahl der Kohlenstoffatome der Carbonsäure entspricht, aus der sie entstanden sind. Darüber hinaus wird für jeden Wasserstoff der substituierten Aminogruppe ein N platziert. Daher werden die verschiedenen Substituenten mit Angabe ihrer Menge benannt und am Ende des Namens das Wort Amid platziert. Zum Beispiel:

- Wenn das Molekül gegenüber der Amidgruppe Prioritätsgruppen aufweist, wird das Amid als Substituent bezeichnet. In diesen Fällen wird die Amidgruppe Carbamoyl genannt. Zum Beispiel:
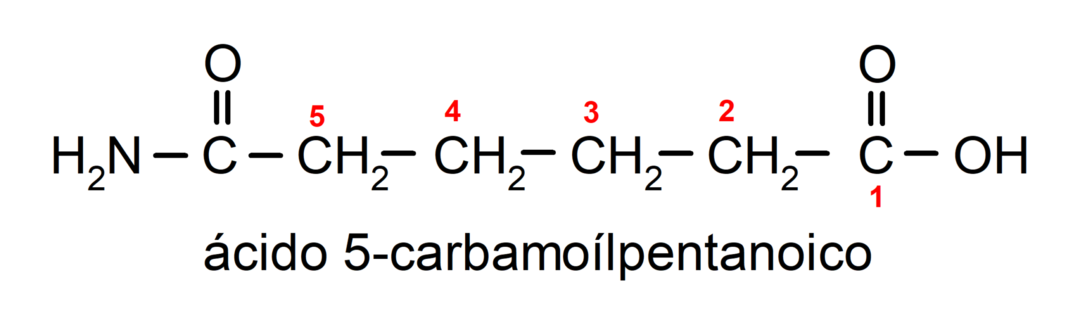
- Wenn das Molekül aus einem Zyklus und einer Amidgruppe besteht, wird der Zyklus als Hauptkette genommen und das Suffix -Carboxamid hinzugefügt. Zum Beispiel:

Physikalische Eigenschaften von Amiden
- Mit Ausnahme von Methanamid sind Amide bei Raumtemperatur fest.
- Sie haben hohe Siedepunkte, sogar höher als die der entsprechenden Carbonsäuren.
- Amide sind gute Lösungsmittel.
- Sie sind schwache Basen.
Chemische Reaktionen von Amiden
- Amide reagieren mit einer wässrigen Säure unter Bildung der entsprechenden Carbonsäure und eines Ammoniumsalzes. Zum Beispiel:

- Amide reagieren mit Alkali unter Bildung der entsprechenden Carbonsäure und eines Carboxylatsalzes. Zum Beispiel:
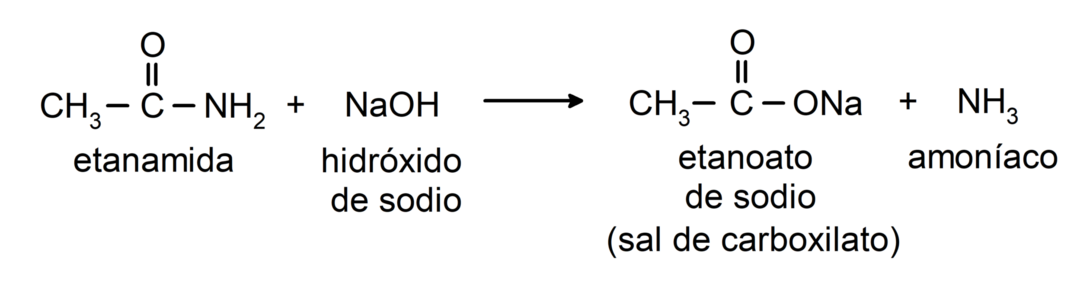
- Amide werden in Gegenwart von Lithiumaluminiumtetrahydrid zu Aminen reduziert:
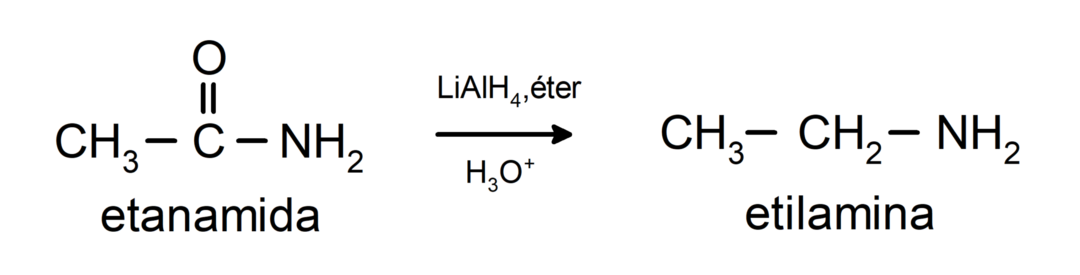
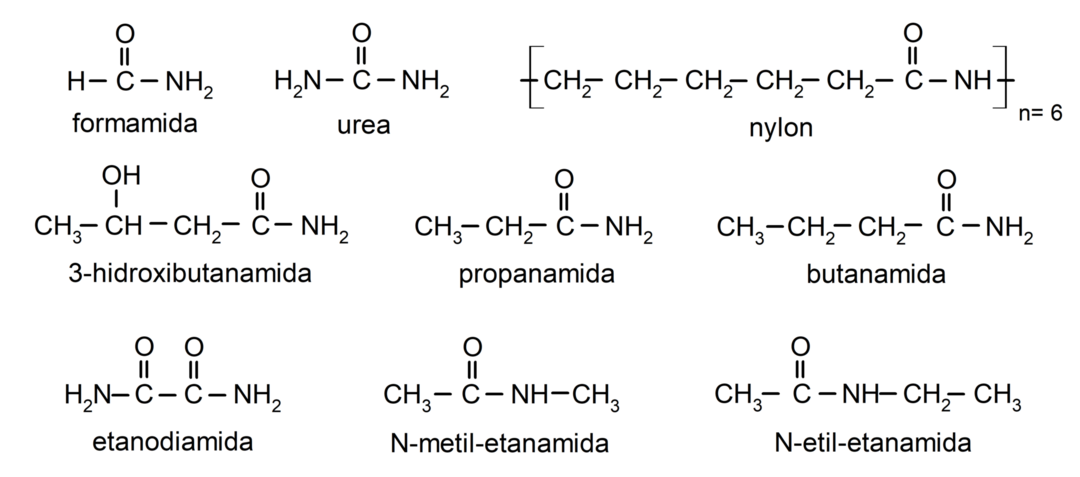
Beispiele für Amide
- Formamid
- Harnstoff
- Nylon
- ε-Caprolactam
- Etanamid
- Propanamid
- Butanamid
- Ethandiamid
- N-Methylethanamid
- N-Ethylethanamid
- N-Propylethanamid
- N, N-Dimethylbutanamid
- Benzolcarboxamid
- 4-Brom-3-methyl-cyclohexancarboxamid
- 3-Hydroxybutanamid

Verwendung von Amiden
Amide werden in der pharmazeutischen Industrie häufig verwendet. Darüber hinaus werden sie als Formtrennmittel in der Kunststoffindustrie eingesetzt. Andererseits werden sie als Emulgatoren, Tenside und Lösungsmittel eingesetzt. Harnstoff ist beispielsweise ein Amid, das in der Pharmaindustrie und der Nylonindustrie weit verbreitet ist.
Verweise
- Ramírez-Barrón, S. N., Sáenz-Galindo, A., López-López, L. und Cantú-Sifuentes, L. (2013). Amide, Anwendung und Synthese. Wissenschaftliches Magazin der Autonomen Universität Coahuila, 5(9).
- Caglieri, S. C., & Pagnan, M. (2013). Theoretische Studie zur sauren Hydrolyse aliphatischer und aromatischer Amide. Technologische Informationen, 24(3), 35-40.
- Martinez, C. H. M., Gomez, L. UND. P., de Escobar, M. S., & Escalante, F. ZU. (2002). organische Chemie. Universität Las Palmas de Gran Canaria, Vizerektorat für Studien und Lehrqualität.
Folge mit:
- Aldehyde
- Alkohole
- Makronährstoffe und Mikronährstoffe
- Organische und anorganische Verbindungen
