30 Beispiele für Aldehyde
Beispiele / / November 06, 2023
Der Aldehyde Sind organische Verbindungen die aus einer Kohlenstoffkette bestehen, an der eine endständige Carbonylgruppe (= C = O) angebracht ist (die sich an einem Ende befindet). Molekül), das wiederum an ein Wasserstoffatom gebunden ist.
Sehr verbreitete Aldehyde sind Methanal (Formaldehyd), Ethanal (Acetaldehyd) und Propanal (Propaldehyd).

Einige dieser Verbindungen kommen in der Natur vor, beispielsweise Vanillin oder Vanillin ist ein natürlicher Aldehyd, der den Hauptgeschmack von Vanille darstellt.
- Siehe auch: Aldehyde und Ketone
Nomenklatur der Aldehyde
Aldehyde können nach den Nomenklaturregeln der International Union of Pure and Applied Chemistry (IUPAC) benannt werden.
Um einen Aldehyd zu benennen, werden Präfixe verwendet, die die Anzahl der Kohlenstoffatome angeben, die die Kohlenstoffkette an die Carbonylgruppe gebunden hat. Die Carbonylgruppe befindet sich immer an einem Ende der Kohlenstoffkette, was bedeutet, dass sie immer die erste Position einnimmt und es nicht notwendig ist, ihre Position in der Kette anzugeben. Zusätzlich wird das Suffix -al am Ende des Aldehydnamens platziert. Einige Beispiele sind:
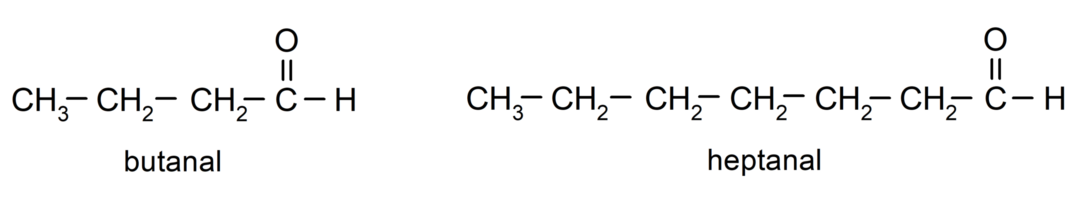
Ist der Aldehyd verzweigt, das heißt, er besteht aus mehreren Kohlenstoffketten, dem Als Hauptkette gilt die Kette, die die größte Anzahl an Kohlenstoffatomen aufweist und die auch die Gruppe enthält Carbonyl. Die restlichen Ketten werden als Substituentengruppen bezeichnet.
Darüber hinaus muss jede Substituentengruppe so gewählt werden, dass ihre Position die niedrigstmögliche Nummerierung in der Hauptkohlenstoffkette einnimmt. Andererseits beginnt die Zählung der Kohlenstoffatome der Hauptkette an dem Ende, das die Carbonylgruppe enthält. Einige Beispiele sind:
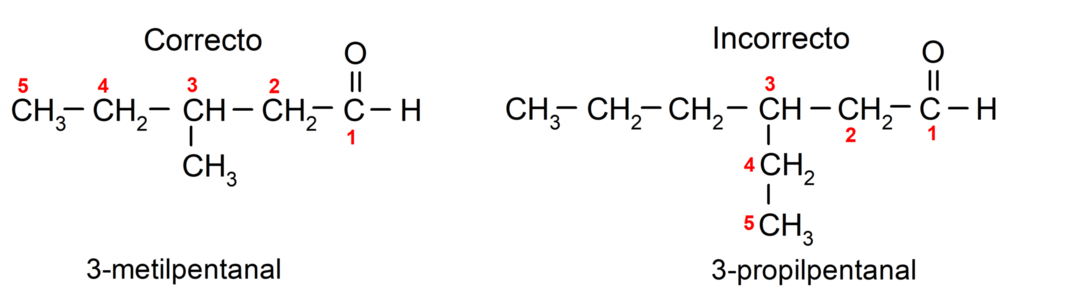
Wenn der Aldehyd im Molekül als Substituent fungiert, ist er ebenfalls aus Gruppen aufgebaut B. Säuren und Ester, dann wird die Aldehydgruppe benannt -oxo. Zum Beispiel:

Wenn ein Aldehyd mehrere Carbonylgruppen aufweist, wird er mit Präfixen benannt, die die Anzahl dieser Gruppen angeben: Dial (zwei Carbonylgruppen), Trial (drei Carbonylgruppen) usw. Zum Beispiel:
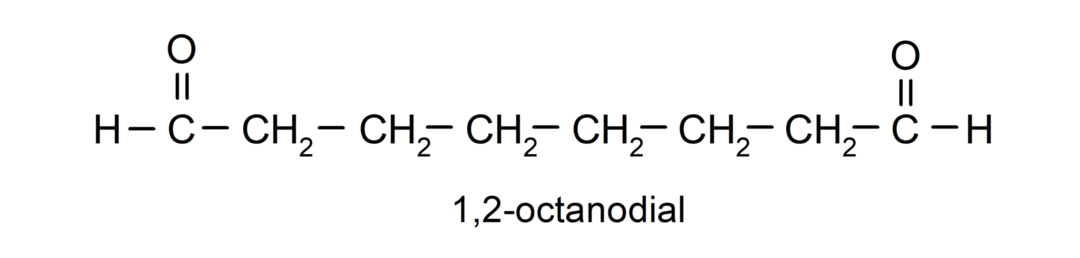
Wenn die Carbonylgruppe an einen Ring gebunden ist, werden Aldehyde mit dem Begriff Carbaldehyd bezeichnet. Zum Beispiel:

Physikalische Eigenschaften von Aldehyden
Aldehyde weisen normalerweise einige Variationen derselben physikalischen Eigenschaften auf. Dies liegt daran, dass die physikalischen Eigenschaften von Aldehyden davon abhängen, wie die Kohlenstoffkette gebildet wird, die an die Carbonylgruppe gebunden ist.
Einige physikalische Eigenschaften von Aldehyden sind:
- Löslichkeit. Die Wasserlöslichkeit von Aldehyden hängt von der Menge ab Atome das hat die Kohlenstoffkette. Aldehyde mit kürzeren Kohlenstoffketten (bis zu etwa fünf Kohlenstoffatomen) sind in Wasser löslich. Aldehyde mit Kohlenstoffketten aus vielen Kohlenstoffatomen sind in Wasser nicht löslich. Methanal und Ethanal sind in Wasser sehr gut löslich.
- Dichte. Im Allgemeinen sind Aldehyde Verbindungen, die eine geringere Dichte als Wasser haben.
- Aggregationszustände. Aldehyde bestehen aus einem und zwei Kohlenstoffatomen Gase, diejenigen, die zwischen drei und zwölf Kohlenstoffatome enthalten Flüssigkeiten, und solche, die aus mehr als zwölf Kohlenstoffatomen bestehen, sind fest.
- Geruch. Einige Aldehyde haben einen irritierenden Geruch, während andere einen angenehmen Geruch haben.
- Polarität. Die Carbonylgruppe verleiht ihnen Polarität.
- Siedepunkt. Sie haben höhere Siedepunkte als Alkane mit ähnlichem Molekulargewicht und niedrigere Siedepunkte als Carbonsäuren und Alkohole mit vergleichbarem Molekulargewicht.
Chemische Eigenschaften von Aldehyden
Einige der chemischen Eigenschaften von Aldehyden sind:
Aldehyde werden oxidiert, wenn sie mit Tollens-, Benedict- und Fehling-Reagenzien reagieren. um die entsprechende Carbonsäure zu bilden. Die gebildete Säure hat die gleiche Anzahl an Kohlenstoffatomen in der Kohlenstoffkette wie der Aldehyd, aus dem sie gebildet wurde. Zum Beispiel:
- Oxidation mit Tollens-Reagenz (ammoniakalischer Silberkomplex in basischer Lösung, [Ag (NH).3)2]+). Bei dieser Reaktion entstehen die entsprechende Säure und metallisches Silber.

- Oxidation mit Benedict- und Fehling-Reagenz (alkalische Lösungen von Kupfer(II)sulfat (CuSO).4) mit unterschiedlichen Zusammensetzungen). Bei dieser Reaktion entstehen die entsprechende Säure und Kupferoxid (Cu).2ENTWEDER).

Sie durchlaufen nukleophile Additionsreaktionen, wobei Nukleophile an die Carbonylgruppe von Aldehyden angehängt werden. Einige Beispiele sind:
- Additionsreaktionen Alkohole an die Carbonylgruppe von Aldehyden unter Bildung von Acetalen und Halbacetalen.
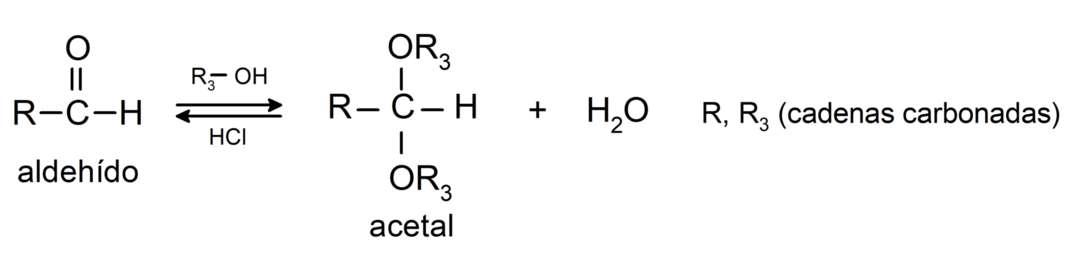
- Additionsreaktionen Amine primär gegenüber der Carbonylgruppe.

- Additionsreaktionen von Blausäure (HCN), bei denen Cyanhydrine oder Cyanhydrine gebildet werden.

Sie durchlaufen Aldolkondensationsreaktionen. Bei dieser Art von Reaktion kondensieren zwei Aldehyde zu einem Aldol. Dabei handelt es sich um Reaktionen, die mit Natriumhydroxid (NaOH) auftreten. Zum Beispiel:
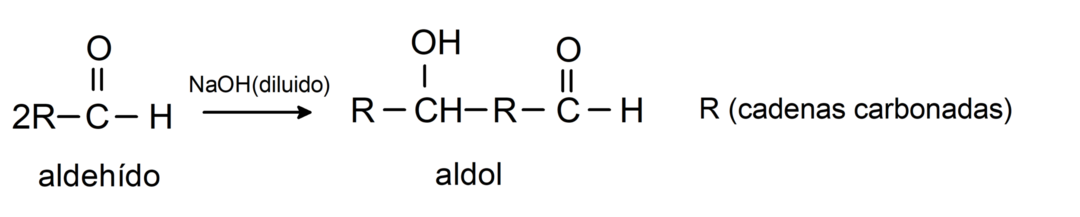
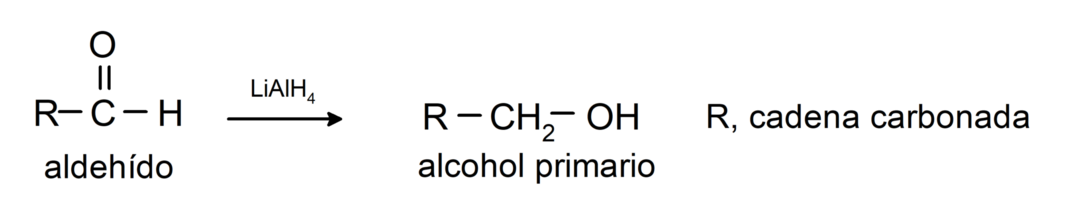
Sie unterliegen Reduktionsreaktionen zu primären Alkoholen. In Gegenwart von Natriumborhydrid (NaBH4) und Lithiumaluminiumhydrid (LiAlH4) oder durch katalytische Hydrierung werden sie zu primären Alkoholen reduziert. Zum Beispiel:
Beispiele für Aldehyde
- Methanal (Formaldehyd)
- Ethanal (Acetaldehyd)
- Propanal (Propaldehyd)
- Butanal
- Pentanal
- Vanillin
- Zimtaldehyd
- Propenal
- Benzaldehyd
- Hexanal
- 3-Bromcyclopentancarbaldehyd
- Cyclohexancarbaldehyd
- 4,4-Dimethylpentanal
- 2-Hydroxybutanal
- 2-Hydroxy-2-methylbutanal
- 2,3-Dimethylpentanal
- Pentanial
- Cyclopentancarbaldehyd
- Isobutanal
- 2-Chlorbutanal

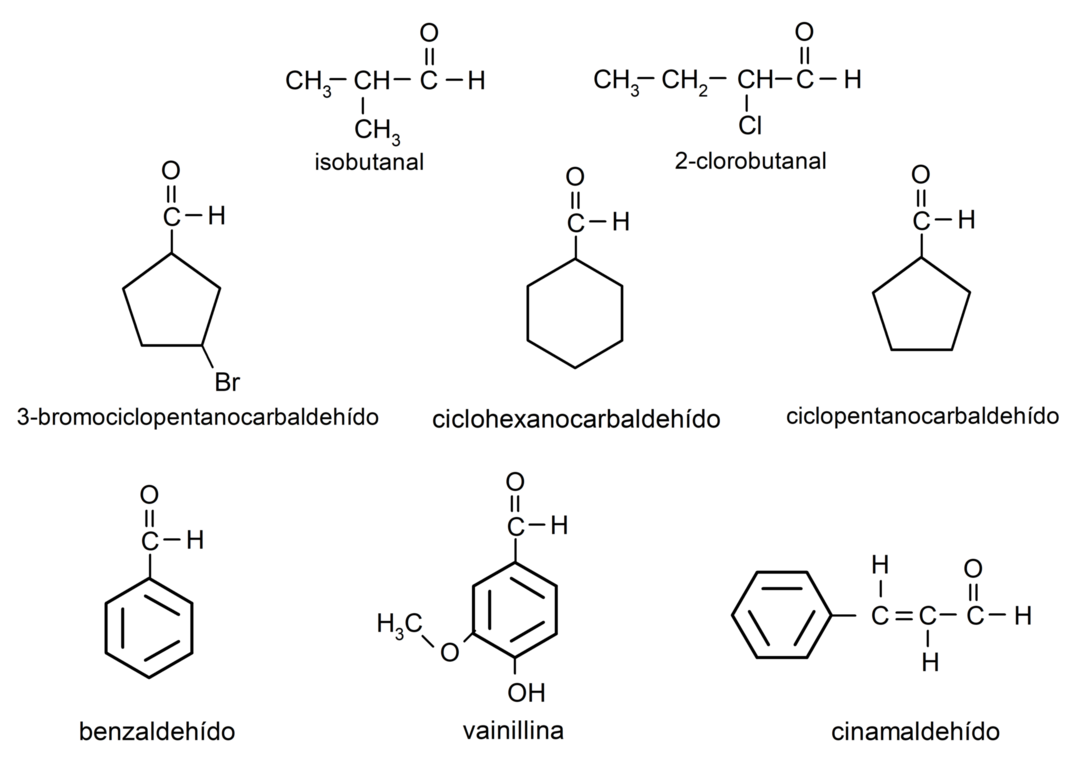
Aldehyde in der Natur
Einige in der Natur vorkommende Aldehyde sind:
- Benzaldehyd, ein Bestandteil von Mandeln.
- Zimtaldehyd, der Bestandteil, der der Zimtessenz ihren Geruch verleiht.
- Vanillin, die Komponente, die der Vanille ihren Geschmack verleiht.
Andererseits weist eine der Formen von Glucose, die offene Form, eine funktionelle Aldehydgruppe auf.
Es wird angenommen, dass Acetaldehyd, das als Zwischenprodukt bei der Verstoffwechselung von Alkohol entsteht, bei einer Alkoholvergiftung Katersymptome verursacht.
Verwendung von Aldehyden
Zu den Hauptverwendungszwecken von Aldehyden gehören:
- Sie werden bei der Herstellung von Lösungsmitteln, Farben, Kosmetikprodukten und Essenzen verwendet.
- Sie werden bei der Herstellung von Harzen verwendet. Bakelit wird aus Formaldehyd hergestellt und ist ein Harz, das sich sehr gut als elektrischer Isolator eignet.
- Sie wurden als Beruhigungsmittel eingesetzt. Paraldehyd wurde als Beruhigungsmittel und Hypnotikum verwendet, obwohl es aufgrund seines unangenehmen Geruchs heute nicht mehr verwendet wird.
- Sie werden als Konservierungsmittel für biologische Proben und Leichen verwendet. Formaldehyd wird in diesem Sinne häufig verwendet.
- Sie werden als Aromastoffe für Lebensmittel verwendet. Ein Beispiel ist Vanillin, das verwendet wird, um Desserts ein Vanillearoma zu verleihen.
- Sie werden als Desinfektionsmittel eingesetzt.
Gefahren von Aldehyden
Mehrere Aldehyde gelten als krebserregend, beispielsweise wurde Formaldehyd laut WHO (Weltgesundheitsorganisation) als krebserregende Verbindung eingestuft.
Die Exposition und der Kontakt mit vielen Aldehyden führen zu Reizungen der Haut, der Augen und der Atemwege. Andererseits verursacht es Kontaktdermatitis und Lebererkrankungen.
Verweise
- Solomons, T.W. Graham und María Cristina Sangines Franchini (1985). “organische Chemie„Mexiko, D.F.: Limusa.
- Whitten, K. W., Gailey, K. D., Davis, R. E., de Sandoval, M. T. ZU. O., & Muradás, R. M. G. (1992). “Allgemeine Chemie" (S. 108-117). McGraw-Hill.
- Arteaga, P. M. (2017). “Ketone und Aldehyde„Con-Science Scientific Bulletin der Vorbereitungsschule Nr. 3, 4(8).
Folge mit:
- Zucker
- Hydracide
- Ethylalkohol
- Organische und anorganische Verbindungen
