20 Beispiele für Amine
Beispiele / / November 06, 2023
Der Amine Sind organische chemische Verbindungen Ammoniakderivate (NH3), wobei mindestens einer der Wasserstoffatome von Ammoniak durch eine Alkyl- oder Arylgruppe ersetzt wurde, was zur Bildung einer Aminogruppe (-NH) führt2, -NH-, -N=). Zum Beispiel:Methylamin, Ethylamin und Propylamin.

Eine Alkylgruppe ist ein Substituent, der entsteht, wenn ein Wasserstoff aus einem gesättigten Kohlenwasserstoff entfernt wird. Auf diese Weise kann sich der Kohlenstoff, von dem dieser Wasserstoff abgetrennt wurde, an einen anderen binden Atom. Zum Beispiel: Methyl (CH3 -) und Ethyl (CH3 - CH2 -).
Eine Arylgruppe ist ein Substituent, der von einem aromatischen Ring wie Benzol abgeleitet ist. Zum Beispiel: Phenyl (C6H5 -)
- Siehe auch: Amide
Arten von Aminen
Amine können nach der Anzahl der an den Stickstoff gebundenen Wasserstoffatome klassifiziert werden, die durch funktionelle Alkyl- oder Arylgruppen ersetzt wurden.
Nach diesem Kriterium gibt es:
- primäre Amine. Sie entstehen, wenn nur eines der Wasserstoffatome des Ammoniaks durch eine Alkyl- oder Arylgruppe ersetzt wird. Zum Beispiel: Ethylamin und 1-Pentylamin.
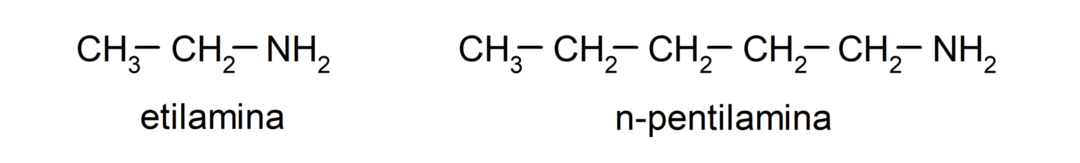
- sekundäre Amine. Sie entstehen, wenn zwei der Wasserstoffatome von Ammoniak durch eine Alkyl- oder Arylgruppe ersetzt werden. Zum Beispiel: Diethylamin und Ethylmethylamin.
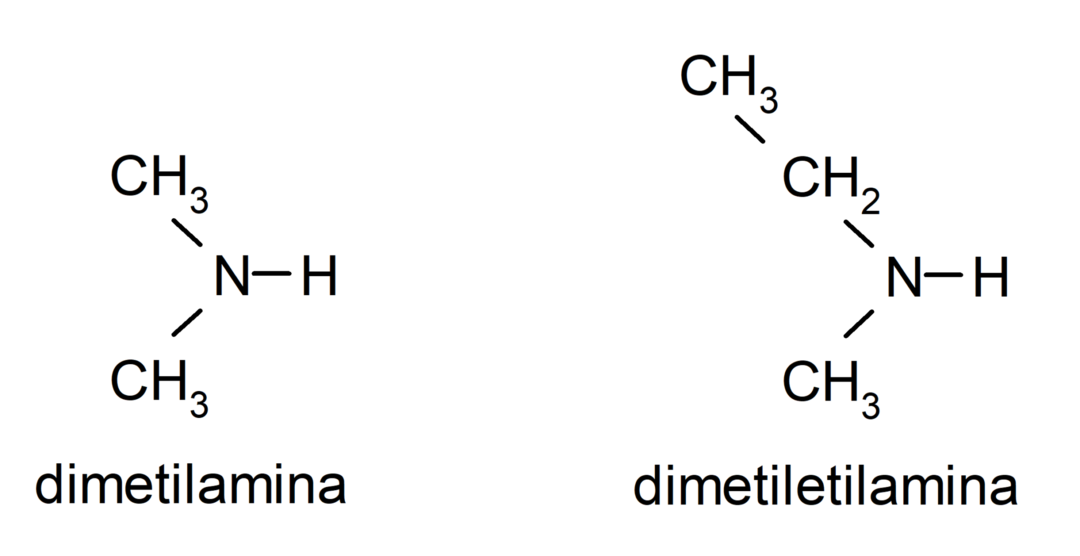
- Tertiäre Amine. Sie entstehen, wenn die drei Wasserstoffatome des Ammoniaks durch eine Alkyl- oder Arylgruppe ersetzt werden. Zum Beispiel: Trimethylamin und Dimethylethylamin.
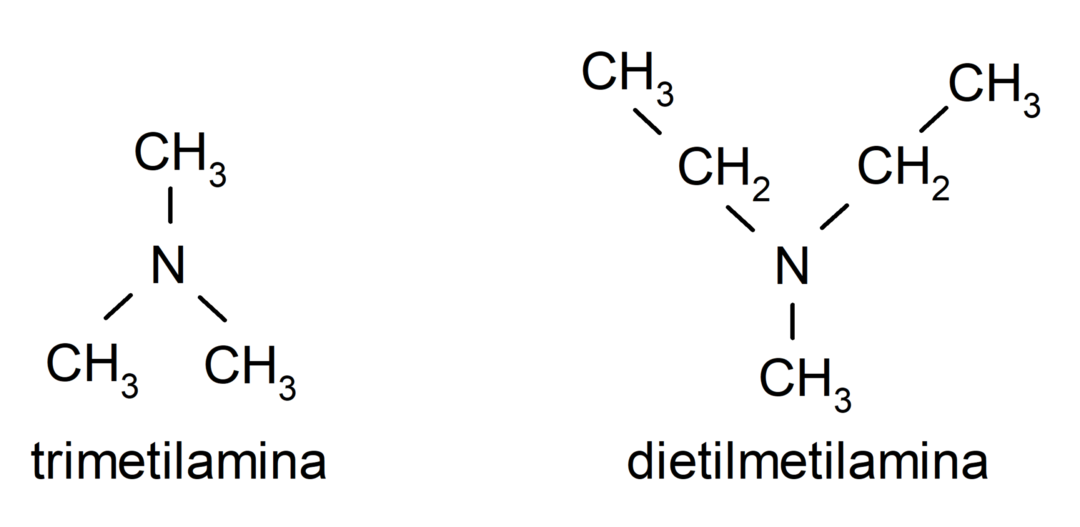
Amine werden auch nach der Art der Gruppe klassifiziert, die an den Stickstoff gebunden ist. Nach diesem Kriterium gibt es:
- Aliphatische Amine. Sie haben Alkylsubstituenten. Zum Beispiel: Butylamin und Diethylamin.

- aromatische Amine. Sie haben Arylsubstituenten. Zum Beispiel: Phenylamin (Anilin) und Diphenylamin.
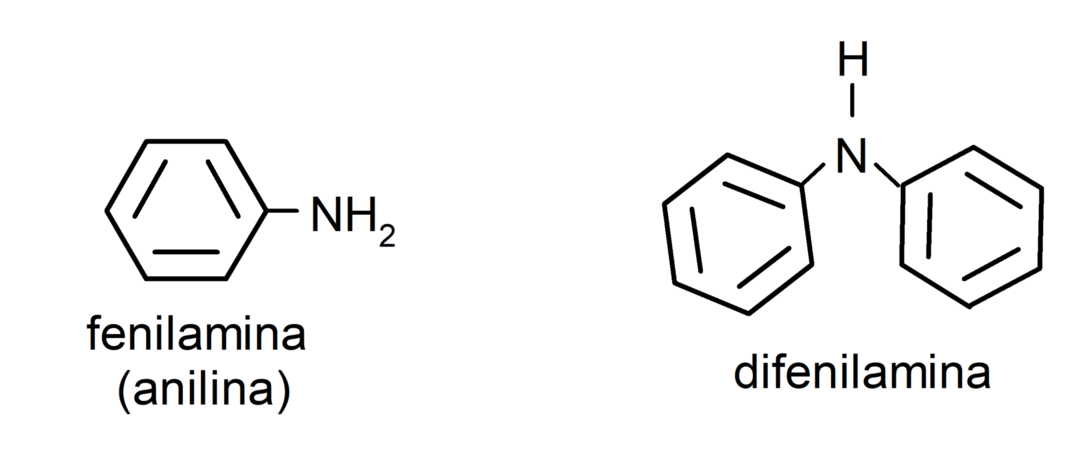
Nomenklatur der Amine
Laut IUPAC (International Union of Pure and Applied Chemistry) werden Amine nach folgenden Regeln benannt:
Bei den einfachsten Aminen wird jeder Substituent der an den Ammoniakstickstoff gebundenen Wasserstoffgruppen benannt. Dann wird das Wort „Amin“ am Ende des Namens platziert.
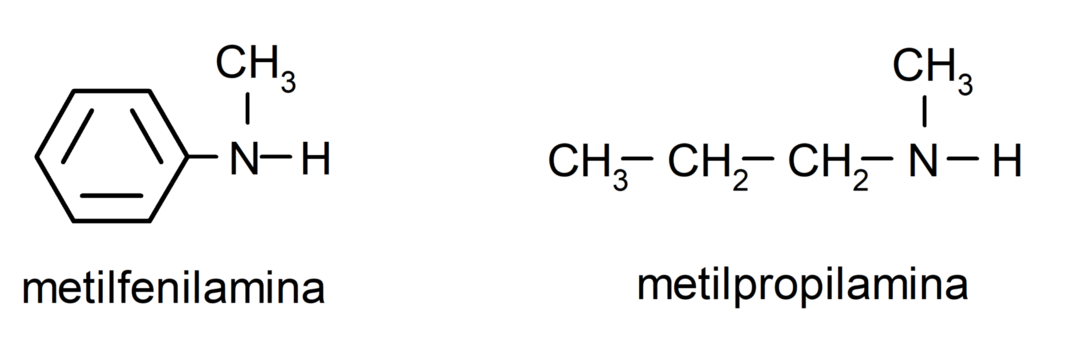
Bei Aminen, die mehrere Kohlenstoffketten enthalten (die wiederum andere Substituenten haben), wird die Kohlenstoffkette, die die Aminogruppe enthält, als Hauptkette gewählt. Darüber hinaus wird die Position der Aminogruppe so gewählt, dass sie die kleinste Position in der Kohlenstoffkette einnimmt, und zwar in Ausgehend von dieser Position werden auch die Substituenten so gewählt, dass sie eine möglichst kleine Position in der Gruppe einnehmen Kette.
Abschließend werden sie mit dem Namen des entsprechenden Alkans, Alkens oder Alkins für die Hauptkette benannt und mit dem Suffix Amin versehen.
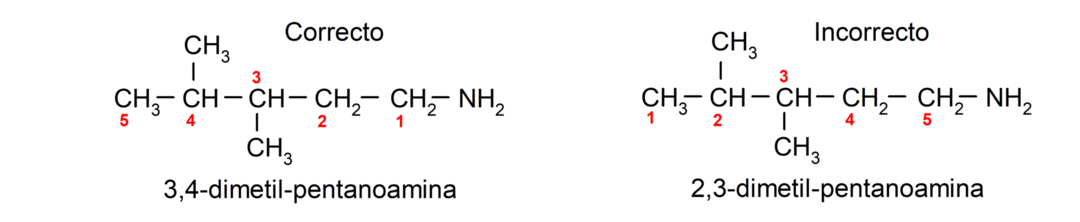
Enthält die Kohlenstoffkette mehrere Aminogruppen, werden diese entsprechend der Position ausgewählt, die sie in der kleinsten Kombination der Nummerierung ihrer Positionen einnehmen. Zusätzlich wird der Name des entsprechenden Alkans, Alkens oder Alkins platziert, gefolgt von dem Begriff, der die Anzahl der Aminogruppen angibt, gefolgt vom Suffix „Amin“.

Physikalische Eigenschaften von Aminen
Die physikalischen Eigenschaften von Aminen hängen weitgehend davon ab, wie viele an den Stickstoff gebundene Wasserstoffe ersetzt wurden und durch welche Art von Substituenten sie ersetzt wurden.
- Löslichkeit. Im Allgemeinen sind Amine in Wasser besser löslich als die entsprechenden gesättigten Kohlenwasserstoffe. Darüber hinaus sind Amine mit langen Kohlenstoffketten in Wasser weniger löslich als Amine mit kurzen Kohlenstoffketten. Andererseits sind aromatische Amine nicht wasserlöslich.
- Siedepunkt. Der Siedepunkt von Aminen liegt höher als der von Alkanen mit der gleichen Anzahl an Kohlenstoffatomen.
- Geruch. Die meisten Amine haben unangenehme Gerüche. Beispielsweise riecht Putrescin nach verrottendem Fleisch und Trimethylamin nach verrottendem Fisch.
Chemische Eigenschaften von Aminen
Einige chemische Eigenschaften von Aminen sind:
- Es handelt sich um chemische Grundverbindungen, Das heißt, sie gehen Reaktionen ein, bei denen sie gemäß der Brønsted-Lowry-Theorie Protonen aufnehmen. Zum Beispiel:
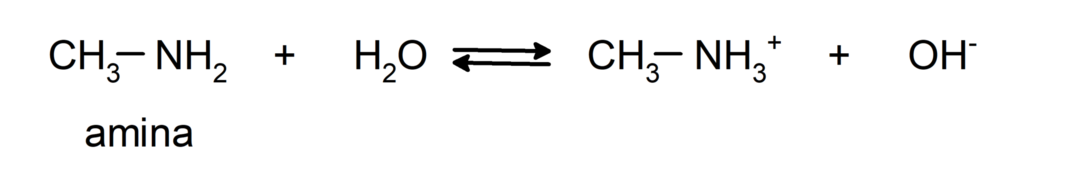
- Sie zeigen Neutralisationsreaktionen mit Säuren, in denen Aminsalze entstehen. Zum Beispiel:

Beispiele für Amine
- Methylamin
- Ethylamin
- Propylamin
- Dimethylamin
- Ethylmethylamin
- Phenylamin (Anilin)
- Diphenylamin
- Methylpropylamin
- Butan-1,4-diamin
- Spermin
- Cadaverin
- 3,5-Dimethylanilin
- Methylanilin
- Amphetamin
- Piperazin


Biologische Funktion von Aminen
Amine sind in vielen vorhanden Lebewesen und verschiedene Funktionen ausführen. Einige Amine wie Adrenalin, Noradrenalin, Serotonin und Dopamin sind Neurotransmitter.
Die Aminogruppe ist eine der funktionellen Gruppen, die Aminosäuren bilden, die die Grundeinheiten von bilden Proteine. Darüber hinaus enthalten die stickstoffhaltigen Basen, aus denen DNA und RNA bestehen, Aminogruppen.
Verwendung von Aminen
Einige Anwendungen von Aminen sind:
- Sie werden zur Herstellung agrochemischer und pharmazeutischer Verbindungen verwendet.
- Sie werden als Katalysatoren bei der Herstellung von Polyurethanen eingesetzt.
- Aufgrund ihrer dämpfenden Wirkung werden sie zur Korrosionshemmung in wässrigen Umgebungen eingesetzt.
- Sie werden zur Reinigung von Gasen in Kraftwerken und Raffinerien eingesetzt.
- Sie werden zur Herstellung von Reinigungsmitteln verwendet.
- Sie werden zur Herstellung von Körperpflegeprodukten verwendet, da sie die Schaumbildung in Seifen und Shampoos verbessern.
Toxizität von Aminen
Das Einatmen hoher Aminkonzentrationen führt zu Vergiftungen, die wiederum zu erhöhtem Blutdruck und Krampfanfällen führen. Darüber hinaus besteht Kontakt mit aliphatischen Aminen Gaszustand verursacht Reizungen der Augen und Atemwege. Mehrere Amine verursachen bei Kontakt Hautverbrennungen.
Aromatische Amine sind sehr giftig, aber da sie viel weniger flüchtig sind als aliphatische Amine, lässt sich der Kontakt mit ihnen besser kontrollieren.
Verweise
- Pérez, C. R. C., & Jiménez-Colmenero, F. (2010). Biogene Amine: Toxikologische Bedeutung. Elektron. J. Biomed., 3, 58-60.
- Fernández García, M., & Álvarez González, M. Á. (2005). Biogene Amine in Lebensmitteln.
Folge mit:
- Alkohole
- Aldehyde
- Ethylalkohol
- organische Chemie


