30 Beispiele für binäre Verkäufe
Beispiele / / November 09, 2023
Der binäre Salze (neutrale Salze) entstehen, wenn sich ein Metall und ein Nichtmetall verbinden. Sind Chemische Komponenten bestehend aus nur zwei chemische Elemente. Zum Beispiel: Natriumchlorid (NaCl) und Kaliumbromid (KBr).
- Siehe auch: Metalle und Nichtmetalle
Beispiele für binäre Salze
- Natriumchlorid (NaCl)
- Eisen(II)-chlorid (FeCl2)
- Eisen(III)-chlorid (FeCl3)
- Kobalt(II)-sulfid (CoS)
- Kobalt(III)-sulfid (Co2Ja3)
- Blei(II)-sulfid (PbS)
- Blei(IV)-sulfid (PbS2)
- Calciumchlorid (CaCl2)
- Natriumfluorid (NaF)
- Lithiumchlorid (LiCl)
- Strontiumchlorid (SrCl2)
- Bariumchlorid (BaCl2)
- Aluminiumchlorid (AlCl3)
- Magnesiumsulfid (MgS)
- Rubidiumchlorid (RbCl)
- Calciumbromid (CaBr2)
- Kaliumsulfid (K2S)
- Magnesiumbromid (MgBr2)
- Zinksulfid (Zn2S)
- Lithiumbromid (LiBr)
- Nickelchlorid (NiCl2)
- Uran(III)-chlorid (UCl3)
- Silberbromid (AgBr)
- Silberiodid (AgI)
- Kaliumbromid (KBr)
Nomenklatur binärer Salze
Gemäß der traditionellen Nomenklatur werden binäre Salze benannt, indem der Name des nichtmetallischen Elements mit der Endung -ide geschrieben wird. Andererseits wird der Name des metallischen Elements entsprechend seiner Oxidationsstufe geschrieben:
- Für die niedrigste Oxidationsstufe wird mit der Endung -oso geschrieben. Zum Beispiel: Eisenchlorid (FeCl2), wobei Eisen eine Oxidationsstufe von 2+ hat.
- Für die höchste Oxidationsstufe wird mit der Endung -ico geschrieben. Zum Beispiel: Eisenchlorid (FeCl3), wobei Eisen eine Oxidationsstufe von 3+ hat.
Gemäß der Systematischen Nomenklatur werden binäre Salze benannt, indem der Name des nichtmetallischen Elements mit einem Präfix versehen wird, das die Menge angibt Atome dieses Elements in der Verbindung. Zusätzlich wird die Endung -uro im Namen des nichtmetallischen Elements platziert. Anschließend wird der Name des metallischen Elements platziert. Zum Beispiel: Magnesiumdichlorid (MgCl2) und Eisentrichlorid (FeCl3).
Nach der Nomenklatur von Stock werden binäre Salze benannt, indem man den Namen des nichtmetallischen Elements mit der Endung -ide schreibt. Dann wird der Name des metallischen Elements eingegeben, gefolgt von seinem Oxidationszustand in römischen Ziffern und in Klammern. Zum Beispiel: Eisen(II)-chlorid (FeCl2) und Kobalt(III)-sulfid (Co2Ja3).
Anwendungen binärer Salze
- Sie werden als Kältemittel in der Lebensmittel- und Pharmaindustrie eingesetzt. Zum Beispiel: Calciumchlorid (CaCl2).
- Sie dienen zur Behandlung von Metalloberflächen gegen Korrosion. Zum Beispiel: Natriumfluorid (NaF).
- Sie werden zur Regulierung der Luftfeuchtigkeit in der Papier- und Bauindustrie eingesetzt. Zum Beispiel: Calciumchlorid (CaCl2).
- Sie werden in der Glasindustrie zur Beseitigung von Verunreinigungen eingesetzt. Zum Beispiel: Siliziumtetrachlorid (SiCl4).
- Sie werden als Kochzutaten verwendet. Zum Beispiel: Natriumchlorid (NaCl).
Physikalische Eigenschaften binärer Salze
- Sie haben hohe Schmelzpunkte, weil sie aus bestehen ionische Bindungen.
- Sie leiten elektrischen Strom, wenn sie gelöst oder geschmolzen sind.
- Die gebräuchlichsten Salze haben eine geringe Härte.
- Sie sind nicht komprimierbar.
- Die meisten können in Wasser gelöst werden.
Wie werden binäre Salze gewonnen?
Binäre Salze können durch einige der folgenden chemischen Reaktionen gewonnen werden:
Reaktion zwischen einem Metall und einem Nichtmetall. Zum Beispiel: die Reaktion zwischen Natrium (Na) und Dichlorid (Cl2) produziert Natriumchlorid (NaCl).
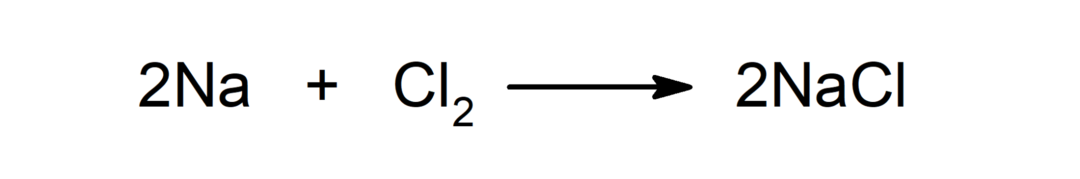
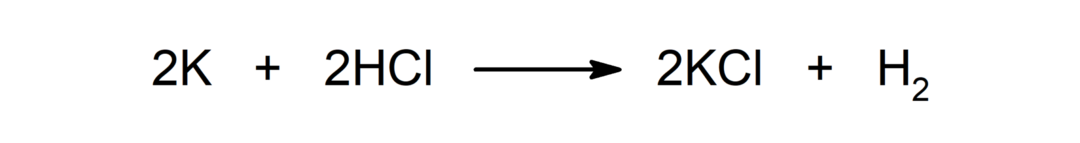
Reaktion zwischen einem Metall und einer Säure. Zum Beispiel: Bei der Reaktion zwischen Kalium (K) und Salzsäure (HCl) entstehen Kaliumchlorid (KCl) und Diwasserstoff (H).2).
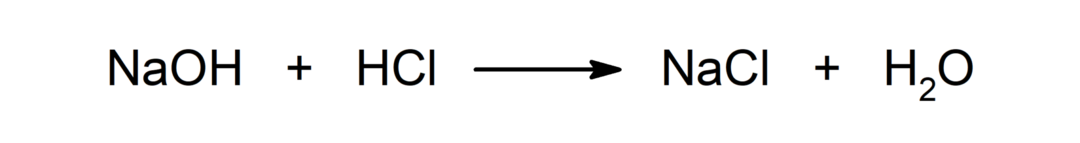
Reaktion zwischen einer Säure und einer Base. Zum Beispiel: Bei der Reaktion zwischen Salzsäure (HCl) und Natriumhydroxid (NaOH) entstehen Natriumchlorid (NaCl) und Wasser (H).2ENTWEDER).
Folge mit:
- Oxysalze
- neutrale Salze
- saure Salze
Verweise
- Cerón Villalba, A., Novoa Ramírez, C. S., & Alpizar Juárez, E. (2020). Nomenklaturvideo 1: Binäre Salze und chemische Reaktion.
- Acurio Arias, M. V., & Delgado Méndez, M. UND. (2022). Spielbasierter Lernleitfaden für „binäre Verbindungen“ in Chemie an der High School der Bildungseinheit „Herlinda Toral“. (Bachelorarbeit, National University of Education).
- Cabrera, M. J. H. (2005). Studium der Grundprinzipien der elektronischen und strukturellen Eigenschaften binärer und ternärer Verbindungen (Doktorarbeit, Universität La Laguna).



