Beispiele für endotherme Reaktionen
Beispiele / / November 09, 2023
A endotherme Reaktion Dabei handelt es sich um eine Reaktion, bei der dem Medium Energie in Form von Wärme entzogen wird. Bei diesen Reaktionen ist es für die Umwandlung der Reaktanten in Produkte erforderlich, dass sie Wärme absorbieren, was dazu führt, dass die Produkte eine größere Energie haben als die Reaktanten, aus denen sie entstanden sind. Einige Beispiele für endotherme Reaktionen sind: Photosynthese und Wasserelektrolyse.
- Siehe auch: Chemische Reaktionen
Beispiele für endotherme Reaktionen im Alltag
Einige der wichtigsten endothermen Reaktionen sind:
Ozonproduktion in der Atmosphäre. Ozon entsteht in der Atmosphäre, wenn molekularer Sauerstoff (O2) absorbiert ultraviolette Strahlung und zerfällt. Dann kann ein Sauerstoffatom (O) mit einem anderen Sauerstoffmolekül (O) interagieren2) und bilden Ozon (O3).

Wasserelektrolyse. Es ist der Prozess, durch den es angewendet wird elektrische Energie zu Wasser, um es in seine beiden Komponenten Wasserstoff (H) und Sauerstoff (O) zu trennen.
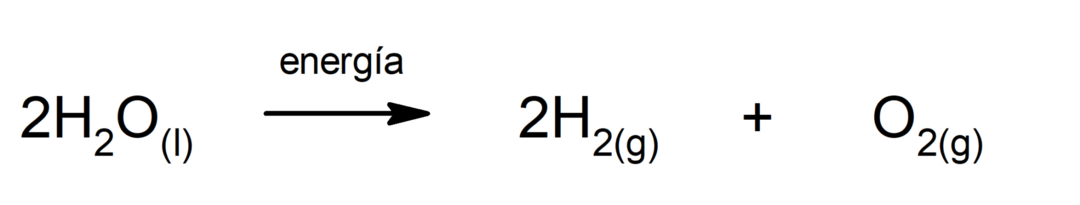
Photosynthese. Es ist die chemische Reaktion, durch die absorbiert wird Solarenergie, Kohlendioxid (CO2) wird in Glukose umgewandelt. Diese Reaktion stellt den Haupternährungsweg für Pflanzen dar.
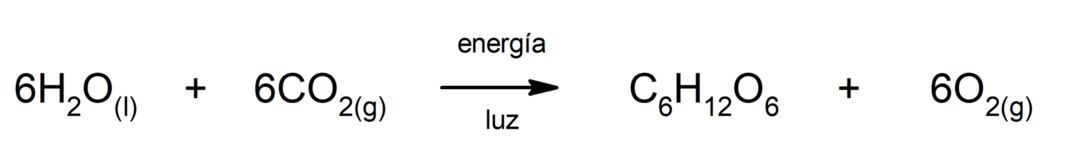
Eisen(II)-sulfid-Produktion. Damit die Reaktion zwischen Schwefel und Eisen stattfinden kann, ist die Bereitstellung von Energie in Form von Wärme erforderlich.
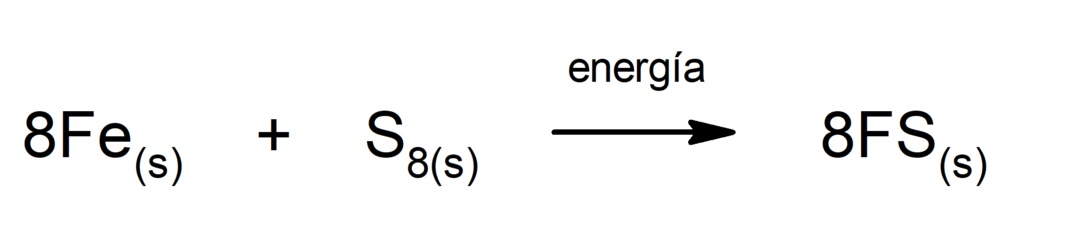
Zersetzung von Kohlendioxid (CO2). Die Zersetzung von CO2 Bei hohen Temperaturen entstehen Kohlenmonoxid (CO) und Sauerstoff (O).2).
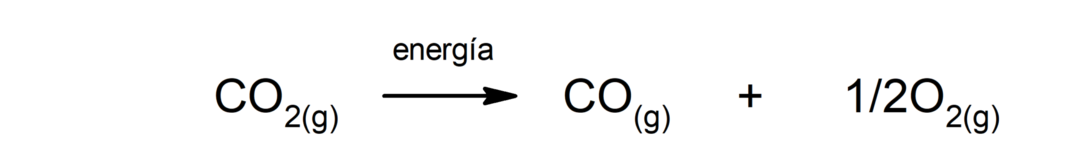
Zersetzung von Calciumcarbonat (CaCO3). Calciumcarbonat zersetzt sich unter Wärmeaufnahme zu Calciumoxid (CaO) und Kohlendioxid (CO).2).
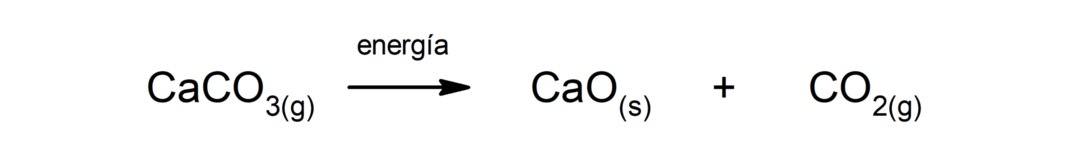
Unterschied zwischen endothermer und exothermer Reaktion
Der Hauptunterschied zwischen endothermen und exothermen Reaktionen besteht darin, dass endotherme Reaktionen Wärme absorbieren, während exotherme Reaktionen Wärme abgeben.
Darüber hinaus zeichnen sich endotherme Reaktionen durch einen Anstieg der Enthalpie aus, während exotherme Reaktionen mit einem Abfall der Enthalpie einhergehen.
Enthalpie ist eine thermodynamische Größe, die den Fluss thermischer Energie bei konstantem Druck während einer chemischen Reaktion definiert. Es wird durch den Buchstaben H dargestellt und seine Variation ist einer der Hauptindikatoren zur Definition, ob eine chemische Reaktion endotherm oder exotherm ist.
- Wenn eine chemische Reaktion eine Enthalpieänderung größer als Null aufweist (ΔH > 0) ist endotherm.
- Wenn eine chemische Reaktion eine Enthalpieänderung von weniger als Null aufweist (ΔH < 0) ist exotherm.
Folge mit:
- Physikochemische Phänomene
- Chemie im Alltag
- Chemie im Alltag
- Organische und anorganische Chemie
Verweise
- Soto-Córdoba, S. (2016). Endotherme Reaktionen. Tech-Repository Technologisches Institut von Costa Rica.
- Corominas, J. (2017). Chemische Reaktionen des Alltags. Destillierkolben, (90), 8-26.
- Sánchez, M. T. M., & Sánchez, M. M. (2002). Experimentelle Untersuchung endothermer Reaktionen für ESO-Studenten. Annalen der Chemie des RSEQ, (4), 36-39.
