Beispiel für eine volumetrische Analyse
Chemie / / July 04, 2021
Auf Analytische Chemie, das Volumetrie ist eine Analysemethode, die aus den Messung des Reagenzvolumens, das benötigt wird, um mit dem Analyten stöchiometrisch zu reagieren, welches der zu bestimmende Stoff ist.
Stöchiometrisch reagieren bezieht sich auf die chemisch wechselwirkenden Stoffe nach der Anteil, der die chemische Gleichung markiert schon ausgeglichen.
Der zu untersuchende Stoff heißt Analyt. Von dieser Substanz wird ein bekanntes und genau abgemessenes Volumen als Probe entnommen, das wir als Aliquot, in einem Erlenmeyerkolben enthalten, um die Analyse zu beginnen.
Konzepte der volumetrischen Analyse
Volumetrische Analyse, als eine Art von Chemische Analyse, tragen beteiligt eine chemische Reaktion. Diese chemische Reaktion wird zwischen der Probe mit einer unbekannten Menge der untersuchten Substanz und einer bekannten Menge einer anderen Substanz, die mit dieser reagieren kann, durchgeführt.
Das Reaktionssubstanzen werden in wässriger Lösung vorliegen, und die Volumina der Lösungen, die bis zum Ende der Reaktion wechselwirkten, werden gemessen, was durch einen Indikator sichtbar wird, der im Inneren des Kolbens Farbe gibt.
In der volumetrischen Analyse wird die wässrige Lösung von Bekannte Konzentration wird als Standardlösung bezeichnet, Standard oder Titriermittel, und dient als Referenz für das Beenden der Reaktion, um die Berechnung durchzuführen, die die Menge der untersuchten Substanz aufdeckt.
Dieses Verfahren, beide Lösungen zur Reaktion zu bringen, heißt Chemischer Abschluss o Bewertung, die der grundlegende Teil der volumetrischen Analyse ist. Besteht aus gehen nach und nach die Standardlösung gießen (Titriermittel) im Aliquot (Probe), bis der Indikator die Änderung mit einem Farbunterschied anzeigt.
EIN Indikator Es ist eine chemische Substanz, die dem Aliquot zugesetzt wird, eine Färbung zeigt und die nach Beendigung der Reaktion die Farbe ändert.
Eine volumetrische Analyse besteht aus einer einfachen Reihe von Schritten:
1.- Vorbereitung der Standardlösung
2.- Vorbereitung der Probe oder des Aliquots
3.- Chemischer Abschluss
4.- Volumenmessung
5.- Berechnung der untersuchten Substanz.
Bis zu dem Punkt, an dem sie es bereits getan haben voll reagiert die beiden Stoffe heißt es Äquivalenzpunkt.
Wie bei jeder chemischen Analysemethode gibt es auch bei der volumetrischen Analyse Anforderungen für gute Ergebnisse:
-Die chemische Reaktion muss sein Selektivd.h. die Standardlösung reagiert nur mit der Probe.
-Die chemische Reaktion muss sein Stöchiometrisch, d. h. befolgen Sie die in der ausgeglichenen chemischen Gleichung markierten Proportionen.
-Die chemische Reaktion muss sein Quantitativ; bezieht sich auf einen Abschluss von 99,9 % am Äquivalenzpunkt.
-Es muss eine geben nachweisbarer Endpunkt der Reaktion, was durch den Indikator besser bestätigt wird.
Primäres Muster
Das Primäre Muster Es handelt sich um Stoffe von hoher Reinheit, deren Konzentration in Lösung direkt aus der Einwaage und der eingesetzten Wassermenge berechnet wird.
A) Ja, kann mit funktionierenden Lösungen reagiert werden, um deren Konzentrationen zu kennen und in Standardlösungen umzurechnen.
Beispiele für Primärmuster sind:
-Natriumcarbonat (Na2CO3): Es wird verwendet, um Säuren wie Schwefelsäure zu standardisieren.
-Kaliumbiphthalat: Es ist der primäre Standard zur Herstellung von Standardlösungen von Basen wie Natriumhydroxid.
-Natriumchlorid (NaCl): Es wird verwendet, um Silbernitratlösungen zu standardisieren.
-Calciumcarbonat (CaCO3): Primärstandard für EDTA (Ethylendiamintetraessigsäure).
Ein Primärmuster muss mehrere wesentliche Merkmale erfüllen:
Muss eine haben Hohe Reinheit, Atmosphärische Stabilität, Fehlen von Hydratationswasser, Kostengünstig und einfach zu bekommen, Ja Hohes Äquivalentgewicht.
Klassifizierung der volumetrischen Analyse
Abhängig von der chemischen Spezies, mit der Sie eine Analyse durchführen, handelt es sich um die Art der Volumetrie:
Säure-Base-Volumetrie: Es funktioniert entweder mit einer Säure oder mit einer Base, um Proben zu analysieren, die Säuren oder Basen enthalten.
Niederschlagsvolumetrie: Auch Argentometrie genannt, verwendet es eine Standardlösung von Silbernitrat, um zu bestimmen, wie viele Chloride in einer Probe enthalten sind.
Komplexitätsvolumetrie: Eine Standardlösung eines Komplexbildners wie EDTA wird verwendet, um die Konzentration von Härte, d. h. Calcium- und Magnesiumcarbonat, im Wasser zu messen.
REDOX Volumetrie: Die Reaktion findet zwischen einer oxidierenden Substanz und einer reduzierenden Substanz statt.
Indikatoren
Von den zahlreichen Indikatoren, die in Volumetrics verwendet werden, stechen drei heraus:
1.- Orangenschnaps: Es nimmt eine orange Färbung im Aliquot an, die mit einer Säure titriert wird. Wenn der Äquivalenzpunkt erreicht ist, wird die Anzeige gelb.
2.- Phenolphthalein: Es ist am Anfang transparent im Aliquot, das mit einer Base betitelt wird. Wenn der Äquivalenzpunkt erreicht ist, wird die Anzeige rosa.
3.- Eriochrom-Schwarz: Es ist der Indikator zur Bestimmung der Wasserhärte. Am Anfang ist es im Aliquot violett, bis es mit einem Komplexbildner titriert wird. Am Ende der Reaktion wird es blau.

Instrumente in einer volumetrischen Analyse
Bei einer volumetrischen Analyse wird eine Reihe von Instrumenten verwendet, die, wenn sie nicht verfügbar sind, nicht angemessen entwickelt werden können:
1.- Messkolben: Es ist ein Behälter wie eine Kugel in seinem unteren Teil, der unten abgeflacht ist und eine dünne Säule hat, in die die Flüssigkeit gegeben wird. Es hat eine Markierung, die anzeigt, wo der Meniskus der Flüssigkeit sein sollte, damit er das genaue Volumen abdeckt. Es wird verwendet, um Standardlösungen zu enthalten; Dank der Genauigkeit seines Volumens wird eine bekannte Konzentration gewährleistet.

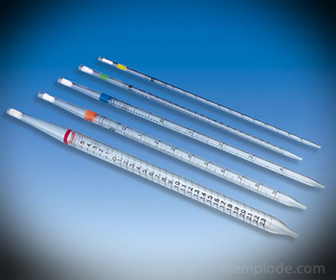
2.- Pipetten: Sie sind graduierte dünne Röhrchen, die es ermöglichen, zuverlässig genaue Flüssigkeitsmengen zu messen. Sie sind bis zu 25 Milliliter erhältlich und ermöglichen eine genaue Probenahme.
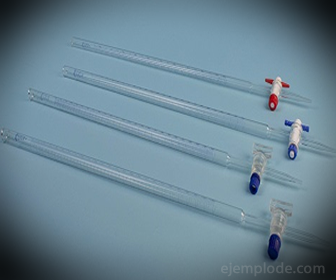
3.- Bürette: Es handelt sich um ein verlängertes Röhrchen mit einem Fassungsvermögen von 50 ml, das die Standardlösung enthält. An einem seiner Enden befindet sich ein Durchflussregulierventil, das die Lösung in das Aliquot ablässt.
4.- Erlenmeyerkolben: Es handelt sich um Behälter mit flachem Boden, konischer Form, die in einem zylindrischen Rand endet. Durch diese Konstruktion sind sie für chemische Titrationen geeignet, da sie beim Schütteln der Lösungen nicht überlaufen. Wenn Wiederholungstests durchgeführt werden sollen, sind mindestens drei erforderlich, um ein zuverlässiges Ergebnis zu gewährleisten.

Berechnungen in einer volumetrischen Analyse
Beim Umgang mit wässrigen Lösungen sind Konzentration und Volumen für eine volumetrische Analyse von Bedeutung.
Die Hauptgleichung der Volumetrie basiert auf vier Hauptdaten:
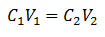
C1= Probenkonzentration (unbekannt)
V1= Volumen des Aliquots, mit dem die Analyse gearbeitet wurde
C2= Konzentration der Standardlösung, die verwendet wurde, um den Äquivalenzpunkt zu erreichen
V2= Volumen der Standardlösung, die benötigt wird, um das Ende der Reaktion zu erreichen
Die Daten werden in die Gleichung eingesetzt, so dass nur die gesuchte Konzentration als unbekannt bleibt. Natürlich müssen sich alle Daten auf denselben Laufwerken befinden.
Beispiele für volumetrische Analysen
Bestimmung von Chloriden (Cl-) durch Argentometrie, mit Silbernitrat.
Bestimmung von Bromiden (Br-) durch Argentometrie, mit Silbernitrat.
Bestimmung von Cyaniden (CN-) durch Argentometrie, mit Silbernitrat.
Bestimmung von Magnesiumcarbonat (MgCO3), durch Komplexometrie, mit EDTA.
Bestimmung von Calciumcarbonat (CaCO3), durch Komplexometrie, mit EDTA.
Schwefelsäureanalyse (H2SW4) mit Natriumhydroxid (NaOH).
Analyse von Natriumhydroxid (NaOH) mit Salzsäure (HCl).
Bestimmung von Antimon (III) mit Kaliumpermanganat (KMnO4).
Bestimmung von Arsen (III) mit Kaliumpermanganat (KMnO4).
Bestimmung von Titan (III) mit Kaliumpermanganat (KMnO4).
Bestimmung von Molybdän (III) mit Kaliumpermanganat (KMnO4).
Bestimmung von Eisen (II) mit Kaliumpermanganat (KMnO4).
Bestimmung von Oxalat-Ionen mit Kaliumpermanganat (KMnO4).



