Was ist Elektrolyse?
Chemie / / July 04, 2021
In Chemie, Elektrolyse ist das Phänomen, bei dem ein elektrischer Strom fließt durch eine wässrige Lösung einer ionischen Verbindung, und beginnt lenke die Ionen (geladene Teilchen) von Verbindung a zwei Elektroden, positiv (Anode, zieht negativ geladene Anionen an) und negativ (Kathode, zieht positiv geladene Kationen an). Dieses Phänomen unterliegt dem Gesetz der Elektrostatik, das anzeigt, dass sich entgegengesetzte Ladungen anziehen.
Elektrolyte
Im Jahr 1883, Michael Faraday entdeckten, dass wässrige Lösungen bestimmter Substanzen elektrischen Strom leiten, während Lösungen anderer Substanzen dies nicht tun.
Um zu testen, ob eine wässrige Lösung elektrischen Strom leitet oder nicht, entwarf Faraday eine einfache Apparatur bestehend aus a 110-Volt-Gleichstromkreis, eine Lampe, Ja zwei Metall- oder Graphitelektroden verbunden zur aktuellen Quelle.
Wenn die Elektroden in Wasser eingetaucht sind, ist der Stromfluss so gering, dass die Lampe nicht leuchtet; das gleiche gilt, wenn sie in eine Zuckerlösung getaucht werden.
Im Gegenteil, wenn sie in eine Lösung von. eingetaucht werden Natriumchlorid NaCl oder von Salzsäure HCl, die Lampe leuchtet hell, was beweist, dass die Auflösung ist ein ausgezeichneter Dirigent. Auf der anderen Seite mit Essigsäure CH3Konzentriertes COOH, die Lösung leitet den Strom schlecht, aber wenn die Säure mit Wasser H. verdünnt wird2Oder seine elektrische Leitfähigkeit nimmt zu.
Beim Stromdurchgang durch unterschiedliche Lösungen werden an den Elektroden unterschiedliche Produkte erhalten.
Im Zuge seines Studiums der Elektrolyse leitete Faraday die folgenden Gesetze ab:
1. Gesetz: Die Stoffmenge, die in einer Elektrode chemisch umgewandelt wird, ist proportional zur Strommenge, die durch die Lösung fließt.
2. Gesetz: Wird die gleiche Strommenge durch verschiedene Lösungen geleitet, so ergeben sich die Gewichte der Stoffe zersetzt oder auf den verschiedenen Elektroden abgelagert sind proportional zu den Äquivalentgewichten der genannten Substanzen.
Um ein Beispiel zu nennen:
Es wird davon ausgegangen, dass Sie über fünf verschiedene Elektrolysezellen verfügen. Die erste mit Salzsäure HCl, die zweite mit Kupfersulfat CuSO4, die dritte mit Antimonchlorid SbCl3, die vierte mit Zinn(II)chlorid SnCl2 und die fünfte mit Zinnchlorid SnCl4.
Der gleiche Strom wird durch eine Reihe von Elektrolysezellen geleitet, bis 1.008 Gramm Wasserstoff freigesetzt wurden (a Äquivalentgewicht von Wasserstoff) der Salzsäurelösung, die Gewichte (in Gramm) der anderen gleichzeitig freigesetzten Produkte products Sie sind:
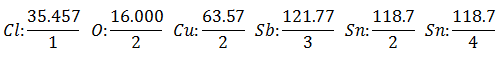
Das Äquivalentes Gewicht hat den Wert von Atomgewicht des Elements geteilt durch das Valencia des Elements.
Um ein gleichwertiges Gewicht eines Artikels freizugeben, benötigen Sie 96500 Coulomb. Diese Strommenge nennt man 1 Faraday.
Die Faraday-Einheit
Ampere ist definiert als ein gleichmäßiger Strom, der 0,001118 Gramm Silber (Ag) aus einer Lösung von Silbernitrat (AgNO3) in einer Sekunde. Da das Atomgewicht von Silber 107,88 g / mol beträgt, das Verhältnis 107,88 / 0,001118 gibt dem Anzahl Ampere-Sekunden oder Coulombomb Strom benötigt ein chemisches Äquivalent von Silber abscheiden. Diese Menge beträgt 96494 Coulomb (der Wert von 96500 ist für einfachere Berechnungen ziemlich ungefähr) und wird 1 Faraday of Electricity genannt.
Elektroden
Faraday rief Anode zu positiver Elektrode und Kathode zu negativer Elektrode. Er schuf auch die Begriffe Anion und Kation, die auf die Substanzen angewendet werden, die bei der Elektrolyse an der Anode bzw. an der Kathode auftreten.
Derzeit ist eine andere Definition für Elektroden:
Anode: Elektrode, bei der es zu Elektronenverlust oder Oxidation kommt.
Kathode: Elektrode, bei der eine Elektronenverstärkung oder -reduktion vorliegt.
Elektrolyte und Nichtelektrolyte
Die Leitung von elektrischem Strom durch Lösungen wurde erst 1887 zufriedenstellend erklärt, als Svante Arrhenius seine Theorie bekannt machte. Bevor wir die Theorie von Arrhenius würdigen und verstehen, haben wir zunächst einige der Fakten dargelegt, die der Wissenschaft bekannt waren, als Arrhenius sie formulierte:
Das Nicht-Elektrolyt-Lösungen sie haben Eigenschaften, die durch Anwendung des Raoult-Gesetzes berechnet werden können. Die Dampfdrücke und die beobachteten Siede- und Gefrierpunkte dieser Lösungen entsprechen praktisch den berechneten Werten.
Das Raoults Gesetz erklärt, dass der Dampfdruck jedes gelösten Stoffes in Lösung von seinem eigenen Molenbruch darin, multipliziert mit seinem Dampfdruck in seinem reinen Zustand, abhängt.

Das Raoultsche Gesetz versagt, wenn es auf Elektrolytlösungen in Wasser angewendet wird. Die Schwankungen des Dampfdrucks und des Siede- und Gefrierpunktes sind immer größer als die vom oben genannten Gesetz vorhergesagten und nehmen außerdem beim Verdünnen zu.
Solche Abweichungen werden durch den Wert i dargestellt, der das Verhältnis der beobachteten Variation des Gefrierpunkts zu der berechneten Variation des Gefrierpunkts ist:

Der Wert von i ist ein Maß für die Abweichung vom Raoult-Gesetz und ist gleich 1, wenn keine Abweichung vorliegt.
Elektrische Leitfähigkeit von Elektrolyten
Arrhenius untersuchte die Leitfähigkeit wässriger Elektrolytlösungen, um herauszufinden, wie sich die Leitfähigkeit mit der Elektrolytkonzentration ändert.
Es maß die molare Leitfähigkeit (das ist die Leitfähigkeit, die einem Mol gelösten Elektrolyten entspricht; das heißt, die spezifische Leitfähigkeit bezog sich auf ein Mol, und es wurde festgestellt, dass sie mit der Verdünnung zunahm.
Arrhenius verglich seine Ergebnisse mit Messungen von Abweichungen vom Raoult'schen Gesetz und fand eine enge Beziehung zwischen diesen und der molaren Leitfähigkeit. In seiner Theorie wird das Verhalten von Elektrolyten erklärt:
„Die Elektrolytmoleküle dissoziieren in elektrisch geladene Teilchen, die Ionen genannt werden. Die Auflösung ist unvollständig und es besteht ein Gleichgewicht zwischen den Molekülen und ihren Ionen. Die Ionen leiten den Strom, während sie sich in der Lösung bewegen.
Abweichungen vom Raoult-Gesetz sind auf die Zunahme der Teilchenzahl aufgrund der teilweisen Dissoziation der Moleküle zurückzuführen.
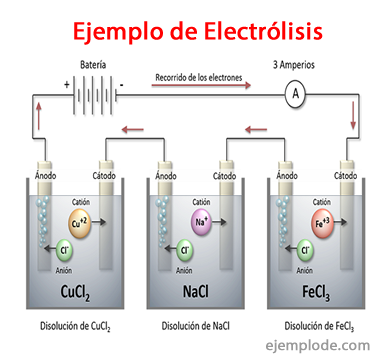
Beispiele für Elektrolyse
Einige Lösungen, die sich wie Elektrolyte verhalten, dh sie haben die Fähigkeit zur Elektrolyse, sind:
Natriumchlorid NaCl
Salzsäure HCl
Natriumsulfat Na2SW4
Schwefelsäure H2SW4
Natriumhydroxid NaOH
Ammoniumhydroxid NH4Oh
Natriumcarbonat Na2CO3
Natriumbicarbonat NaHCO3
Salpetersäure HNO3
Silbernitrat AgNO3
Zinksulfat ZnSO4



