Beispiel für chemische Phänomene
Chemie / / July 04, 2021
Die Chemie untersucht die Bestandteile der Materie, die Verbindungen, die sie bilden und ihre möglichen Kombinationen, die Produkte, die sich aus diesen Kombinationen und ihrer Struktur ergeben, und die Phänomene, die diese erzeugen, beschleunigen oder verzögern Modifikationen. EIN Ein chemisches Phänomen ist ein Phänomen, bei dem zwei oder mehr Stoffe eine Veränderung erfahren, die ihre innere Struktur verändert, wodurch ein, zwei oder mehr Stoffe entstehen, anders als die ursprüngliche Angelegenheit.
Im Gegensatz zu physikalischen Phänomenen, bei denen einige Eigenschaften von Objekten geändert werden, es sich jedoch immer um dieselbe Substanz handelt oder Verbindung, bei physikalischen Phänomenen wird die Struktur von Stoffen verändert, wodurch andere Stoffe übrig bleiben, die sich von Originale. Das heißt, alle chemischen Phänomene sind chemische Reaktionen, die zu einer oder mehreren Substanzen führen, die sich molekular von der oder den ursprünglichen Substanzen unterscheiden.
Arten von chemischen Phänomenen:
Chemische Phänomene können in Bezug auf das Ergebnis wie folgt klassifiziert werden:
Synthese
Zwei oder mehr Verbindungen verbinden sich zu einer komplexeren Verbindung.
Zersetzung
Eine komplexe Verbindung zerfällt, um einfachere Moleküle zu bilden.
Verschiebung
Eines der Elemente oder ein Radikal der reagierenden Moleküle wird Teil des anderen Moleküls, mit dem es reagiert.
Doppelscroll
Die reagierenden Moleküle tauschen ein Element oder ein Radikal aus, wodurch zwei verschiedene Moleküle entstehen, mit denen sie reagiert haben.
Was Reaktionen als chemische Phänomene betrifft, können wir nun Folgendes erwähnen:
Oxidation
Oxidation ist eine Reaktion, bei der sich Sauerstoff mit einem anderen Element verbindet, was bei Metallen ein Oxid und bei Verbindung mit nichtmetallischen Elementen eine Sauerstoffsäure ergibt. Die Reaktion ist langsam und die Temperatur des Materials steigt nicht an.

Verbrennung
Die Verbrennung ist eine Form der schnellen Oxidation, bei der auch Licht und Wärme abgegeben werden, also eine exogene Reaktion.
Alkalisierung
Es ist, wenn sich ein Metall mit einem Hydroxylradikal (Radikal mit der -OH-Form) verbindet.
Ansäuerung
Es ist, wenn ein nichtmetallisches Element mit Wasserstoff kombiniert wird
Neutralisation
Es ist die Kombination eines Hydroxids mit einer Säure, was zur Bildung von Wasser und einem Salz führt.
Die Ermäßigung
Es ist die Eliminierung von Sauerstoff aus einem Oxid, um das reine Metall durch die Reaktion mit Wasserstoff aus einer Säure zu erhalten.
Ionisation
Beim Auflösen eines Salzes in Wasser werden die Elemente, aus denen es besteht, in Atome mit elektrischer Ladung getrennt, die positiv (Kation) oder negativ (Anion) sein kann. Diese Arten von Lösungen werden Elektrolyte genannt.
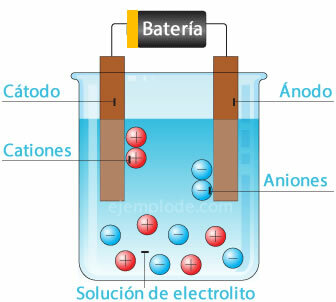
Elektrolyse
Wenn ein elektrischer Strom durch einen Elektrolyten geleitet wird, bewirkt die Elektrizität, dass Atome aus dem Wasser herausbrechen. das Wasserstoff-Ion mit positiver Ladung geht zum negativen Pol (Kathode) und das Sauerstoff-Ion mit negativer Ladung geht zum Pol positiv (Anode). Bei der Elektrolyse in einer Säure besteht einer der Effekte darin, das metallische Element zur Anode zu verlagern.
Katalyse
Zwei Stoffe, die unter allgemeinen Bedingungen nicht oder nur sehr langsam reagieren, können in sehr schnell in Gegenwart einer dritten Substanz, die sich weder vor noch während der Reaktion. Diese Art von Substanz nennt man Katalysatoren.
Fermentation
Es ist die Erzielung einer chemischen Veränderung, insbesondere in organischen Verbindungen, durch die Einwirkung von Bakterien.
Beispiel für chemische Phänomene:
1. Ein unlackierter Grill hat Kontakt mit Luft- und Wassersauerstoff und beginnt zu rosten (Oxidation).
2. Wenn Sie ein Holz näher an das Feuer bringen, verbrennt es und einige der Kohlenstoffmoleküle, aus denen es besteht, werden zu schnell mit Sauerstoff mischen, Kohlendioxid freisetzen, verbranntes Holz und Ruß als Rückstand zurücklassen (Verbrennung)
3. Die Zersetzung der Nahrung ist auf die Verdauungswirkung von Bakterien zurückzuführen, die die chemische Struktur der Bestandteile verändern. (Fermentation).
4. Die Autobatterie erzeugt Strom durch die Reaktion zwischen dem Elektrolyten und den metallischen Zellen, mit denen sie gebildet wird, wodurch Ionen freigesetzt werden, die Strom erzeugen. Um es aufzuladen, führt der Stromfluss eine elektrolytische Aktion durch, die die Ionen zu den Platten zurückführt.
5. Die vom Automotor produzierten Gase sind stabil und zersetzen sich kaum, nachdem sie den Motor verlassen und Raumtemperatur erreicht haben. Der Katalysator enthält einen Platinschaum, der bei Erwärmung auf ca. 500°C lassen Gase in einfachere Verbindungen zerfallen, ohne dass das Platin Modifikationen.
6. Durch das Auflösen von Salz in Wasser spaltet es sich in Natrium- und Chlorionen auf.
7. Das Sprudeln, das beim Mischen von Zitronensaft mit Backpulver auftritt, ist eine Neutralisationsreaktion.
8. Wenn wir bluten, nimmt das Blut aufgrund der Oxidation von Eisen in den roten Blutkörperchen eine dunklere Farbe an. Dies ist auch der Grund, warum venöses Blut dunkler und arterielles Blut heller ist.
9. Beim Verchromen von Automobilteilen wird das Chrom mittels Elektrolyse auf dem zu verchromenden Metallteil abgeschieden.
10. Bei der Verdauung als chemisches Phänomen besteht die Wirkung von Salzsäure auf die Nahrung darin, die komplexe Moleküle, die sie bilden, in kleinere Moleküle, die leichter in die Darm.
