Beispiel für eine kovalente Bindung
Chemie / / July 04, 2021
Das Kovalente Bindung ist derjenige, in dem zwei Atome vereinigen sich, indem sie ihre Elektronen teilen, um seine Oktettregeln zu vervollständigen.
Geschichte der kovalenten Bindung
Anfang des 20. Jahrhunderts begannen Chemiker zu verstehen, wie und warum Moleküle gebildet wurden. Der erste große Durchbruch kam mit dem Vorschlag, Gilbert lewis worüber die Bildung einer chemischen Bindung impliziert, dass Atome teilen Elektronen electron. Lewis beschrieb die Bildung einer chemischen Bindung in Wasserstoff als:
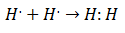
Diese Art der Elektronenpaarung ist ein Beispiel für eine kovalente Bindung, eine Bindung, in der zwei Elektronen teilen sich zwei Atome. Das Kovalente Verbindungen Das sind sie enthalten nur kovalente Bindungen.
Elektronen in der kovalenten Bindung
Der Einfachheit halber gemeinsames Elektronenpaar wird oft dargestellt als einzelne Zeile die Symbole der Elemente verbinden. Daher wird die kovalente Bindung des Wasserstoffmoleküls als H-H geschrieben.
In der kovalenten Bindung ist jedes Elektron des gemeinsamen Paares
wird von den Kernen beider Atome angezogen. Diese Anziehung hält die beiden Atome im H-Molekül zusammen.2 und es ist für die Bildung kovalenter Bindungen in anderen Molekülen verantwortlich.In den kovalenten Bindungen zwischen Atomen mehrerer Elektronen nur Valenzelektronen nehmen teil, die die äußersten sind, im flachsten Orbital. Zwischen einem und drei von ihnen werden sich der Gewerkschaft anschließen.
Die anderen Elektronen, die nicht an der Bindung teilnehmen, heißen Nichtbindende Elektronen, oder wenn wir sie paarweise organisieren, Kostenlose Paare. Das heißt, Paare von Valencia-Elektronen, die nehmen nicht an der Bildung kovalenter Bindungen teil.
Darstellung kovalenter Bindungen
Die Strukturen, mit denen kovalente Verbindungen dargestellt werden, wie H2 und F2 sind bekannt als Lewis-Strukturen. Eine Lewis-Struktur ist a Darstellung einer kovalenten Bindung, wobei das Paar gemeinsamer Elektronen angezeigt durch Linien oder als Punktpaare zwischen zwei Atomen, und die ungeteilten freien Paare sind als Punktpaare auf den einzelnen Atomen angegeben. In einer Lewis-Struktur werden nur die Valenzelektronen gezeigt und nicht die internen.
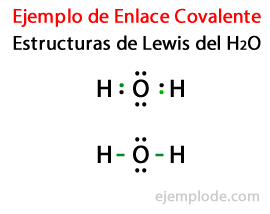
Betrachtet man die Lewis-Struktur für das Wassermolekül H2Oder alle Valenzelektronen der Wasserstoff- und Sauerstoffatome werden zuerst mit Punkten markiert.
In einem zweiten Fall wird der Link mit einer Linie markiert. Und die freien Paare, die es nur in Oxygen geben wird, mit Punkten.
Die Regel des Oktetts
Die Bildung dieser Moleküle, wie die von Wasser H2Oder veranschaulichen Sie den Aufruf Oktettregel, vorgeschlagen von Lewis: Ein anderes Atom als Wasserstoff neigt dazu, Bindungen zu bilden, bis es sich umgibt mit acht ValenzelektronenDas heißt, eine kovalente Bindung bildet sich, wenn nicht genug Elektronen für jedes einzelne Atom vorhanden sind, um sein Oktett zu vervollständigen.
Durch die gemeinsame Nutzung von Elektronen in einer kovalenten Bindung, jedes Atom vervollständigt sein Oktett. Für Wasserstoff ist die Voraussetzung, dass Sie die elektronische Konfiguration von Helium erhalten, die insgesamt zwei Elektronen haben soll.
Die Oktettregel funktioniert hauptsächlich für die Elemente der zweiten Periode oder Reihe des Periodensystems. Diese Elemente haben Unterebenen, in denen sich insgesamt acht Elektronen befinden können.
Wenn ein Atom dieser Elemente eine kovalente Verbindung bildet, erhält es die elektronische Konfiguration des Neon-Edelgases und teilt Elektronen mit anderen Atomen in derselben Verbindung.
Arten kovalenter Bindungen
Atome können verschiedene Arten von kovalenten Bindungen bilden: Einzel-, Doppel- oder Dreibettzimmer.
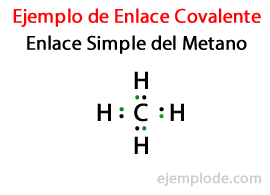
In einem Einfacher Link, zwei Atome werden durch Ein Elektronenpaar. Sie kommen in den allermeisten kovalenten Verbindungen vor und sind die grundlegendste Form dieser Bindung.
In vielen Verbindungen, Doppellinks, das heißt, wenn sich zwei Atome teilen Zwei Elektronenpaare. Wenn zwei Atome zwei Elektronenpaare teilen, wird die kovalente Bindung als Doppelbindung bezeichnet. Diese Bindungen finden sich in Molekülen wie Kohlendioxid (CO2) und Ethylen (C2H4).

EIN Dreifachverbindung entsteht, wenn sich zwei Atome teilen Drei Elektronenpaare, wie im Stickstoff-N-Molekül2, das Acetylen-C-Molekül2H2.

Mehrfachbindungen sind kürzer als einfache kovalente Bindungen. Das Linklänge ist definiert als die Abstand zwischen den Kernen zweier verbundener Atome durch eine kovalente Bindung in einem Molekül.
Unterschiede zwischen kovalenten und ionischen Verbindungen
Ionische und kovalente Verbindungen weisen deutliche Unterschiede in ihren allgemeinen physikalischen Eigenschaften auf, da ihre Bindungen unterschiedlicher Natur sind.
In dem Kovalente Verbindungen existieren zwei Arten von Anziehungskräften; einer von ihnen ist derjenige, der die Atome eines Moleküls zusammenhält. Ein quantitatives Maß für diese Anziehungskraft ist die Bindungsenergie. Die andere Anziehungskraft wirkt zwischen den vollständigen Molekülen und heißt Intermolekulare Kraft. Da intermolekulare Kräfte normalerweise schwächer sind als die Kräfte, die die Atome eines Moleküls zusammenhalten, binden die Moleküle einer kovalenten Verbindung weniger stark.
In Folge, kovalente Verbindungen sind fast immer niedrig schmelzende Gase, Flüssigkeiten oder Feststoffen. Auf der anderen Seite die elektrostatischen Kräfte, die die Ionen zusammenhalten in einer ionischen Verbindung sind sie normalerweise sehr stark, so dass ionische Verbindungen bei Raumtemperatur fest sind und hohe Schmelzpunkte aufweisen. Viele ionische Verbindungen sind in Wasser löslich und ihre wässrigen Lösungen leiten Elektrizität, da diese Verbindungen starke Elektrolyte sind.
Die meisten von den kovalente Verbindungen sind in Wasser unlöslich, und wenn sie sich auflösen, seine wässrigen Lösungen wie gewöhnlich sie leiten keinen Strom weil diese Verbindungen keine Elektrolyte sind. Geschmolzene ionische Verbindungen leiten Elektrizität, weil sie frei bewegliche Kationen und Anionen enthalten; flüssige oder geschmolzene kovalente Verbindungen leiten keinen Strom, da keine Ionen vorhanden sind.
Beispiele für kovalent gebundene Verbindungen
- Acetylen C2H2
- Methan CH4
- Ethan C2H6
- Propan C3H8
- Butan C4H10
- Benzol C6H6
- Toluol C7H8
- Methylalkohol CH3Oh
- Ethylalkohol C2H5Oh
- Propylalkohol C3H7Oh
- Methylether CH3OCH3
- Methylethylether C2H5OCH3
- Ethylether C2H5OC2H5
- Ameisensäure HCOOH
- Essigsäure CH3COOH
- Propionsäure C2H5COOH
- Buttersäure C3H7COOH
- Kohlendioxid CO2
- Kohlenmonoxid CO
- Molekularer Stickstoff N2
- Molekularer Wasserstoff H2


