Arten von chemischen Bindungen
Chemie / / July 04, 2021
Wenn zwei oder mehr Atome ein Molekül bilden, verbinden sie sich durch a Übergang zwischen Elektronen seiner letzten Schichten, die oberflächlichsten. Diese Vereinigung heißt Chemische Bindung. Damit eine chemische Bindung entstehen kann, müssen die Atome ihre unvollständiges Oktett, d. h. weniger als acht Elektronen in ihrer letzten Schale, das ist die Zahl, die ihnen chemische Stabilität verleiht.
Es gibt drei Arten von chemischen Bindungen:
- Ionische Bindungen
- Kovalente Bindungen
- Metallglieder
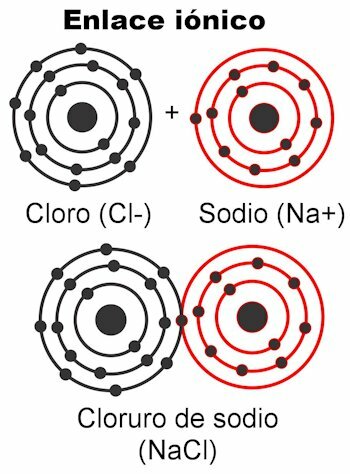
Ionische Bindungen
Ionenbindungen sind solche, in denen die Valenzelektronen werden von elektrostatischen Kräften angezogen. Die Atome mit 1 bis 4 Valenzelektronen können diese abgeben, um die Bindung zu bilden; Dies gibt ihm eine positive Ladung, weil es die negativen Ladungen loswerden würde. Auf der anderen Seite können die Atome mit 5 bis 7 Valenzelektronen die notwendigen Elektronen aufnehmen, um 8 zu erreichen.
Dies gibt ihnen eine negative Ladung, weil sie Elektronen aufnehmen, die negativ sind. Die Tatsache, dass Elektronen eingefangen oder abgegeben werden können
gibt den Atomen die elektrische Ladung. Nach dem Coulomb-Gesetz bilden sich die Ladungen an beiden Atomen Sie werden sich mit einer Kraft anziehen, das ist die oben erwähnte Elektrostatik. Negative Ladungen ziehen positive Ladungen an und umgekehrt. Gegensätze ziehen sich an. Sobald diese Kraft sie zusammenhält, wird das Molekül gebildet.Ionenbindungen treten meistens auf zwischen Metall- und Nichtmetallatomen. Metalle geben ihre Elektronen ab und tragen immer eine positive Ladung und nehmen als Kation (+) teil. Nichtmetalle sind Elektronenrezeptoren und tragen im Allgemeinen eine negative Ladung Anionen (-), aber es kommt auch vor, dass sie eine positive Ladung tragen, wenn sie Gruppen geladener Atome bilden namens Radikale, als Ammonium-NH4+, Carbonat CO3-2, Phosphat PO4-3.
Zu den chemischen Verbindungen, die durch ionische Bindungen gebildet werden, gehören:
- Binäre Salze
- Oxisales
Wenn diese Stoffe in Wasser gelöst sind sie dissoziieren, nämlich in ihre elektrischen Ladungen zerlegen und diese werden zusammen mit den Wasserstoffionen H. im Wasser dispergiert+ und Hydroxyl (OH-) die Wasser bilden. Die sich bildende Mischung ist eine Lösung namens Elektrolyt.
- Weiterlesen: Ionenverbindung
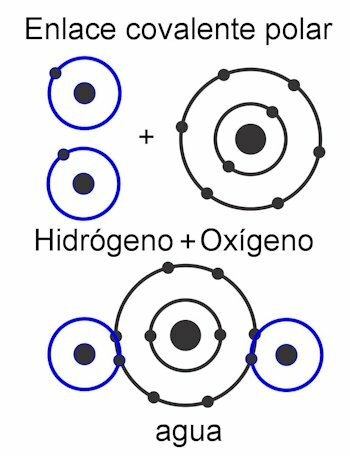
Kovalente Bindungen
Kovalente Bindungen sind solche, in denen Elektronen geteilt werden ohne sie vom Atom zu lösen, also ohne Bildung elektrischer Ladungen. Die Atome werden durch Nähe zusammengehalten und nutzen die Kraft, mit der der Kern Elektronen anzieht. Sobald die Bindung gebildet ist, ziehen die zwei oder mehr Atomkerne die gemeinsamen Elektronen an, wodurch die Oktettregel erfüllt und das Molekül stabil wird.
Es gibt mehrere Formen der kovalenten Bindung, und sie sind:
- Kovalente Bindung
- Koordinierte kovalente Bindung
- Polare kovalente Bindung
- Unpolare kovalente Bindung
Das kovalente Bindung Es ist genau wie das eingangs beschriebene. Die beteiligten Atome teilen sich Elektronen, sodass sie alle ihr vollständiges Oktett haben. Hier gibt es keine elektrischen Ladungen, weil keine Elektronen abgegeben, sondern nur geteilt werden.
In dem koordinative kovalente Bindung es ist nur ein Atom, das alle für die Bindung notwendigen Elektronen beisteuert. Das andere Atom bindet sich einfach zusammen und nimmt diese Elektronen als seine eigenen an. Das Molekül wird so gebildet. Dies ist beispielsweise bei Schwefelsäure H. der Fall2SW4 in der Schwefel zwei Elektronenpaare mit Sauerstoffatomen teilt.
In dem polare kovalente Bindung, sind die Kräfte zwischen den Atomen zu einer Seite des Moleküls geneigt. Diese wenn es verschiedene Arten von Atomen gibt im Molekül. Diese Kraft wird in Debye-Einheiten gemessen, und je höher ihr Wert auf einer Seite des Moleküls ist, desto polarer ist sie. Dies bedeutet, dass Pole in der Struktur gebildet werden, weshalb sie diesen Namen erhalten. Seine Kräfte sind asymmetrisch.
In dem unpolare kovalente Bindung, sind die Kräfte zwischen den Atomen im gesamten Molekül gleichförmig, und daher bilden sich in seiner Struktur keine Pole. Es funktioniert als eine Einheit und deshalb ist es sehr schwierig, fast unmöglich, seine Lasten zu verteilen. Dadurch ist es wasserunlöslich. Dies ist der Fall bei Verbindungen wie alkane, die im gesamten Molekül ihre gleichen Kräfte haben. Seine Kräfte sind symmetrisch.

- Weiterlesen: Kovalente Bindung
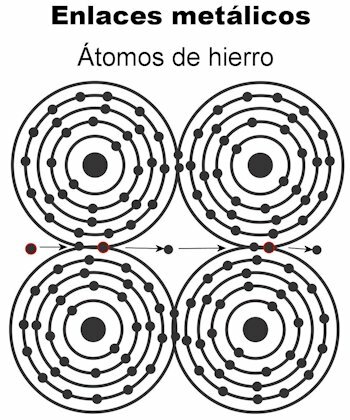
Metallische Bindung
Die Atome eines Metalls werden durch metallische Bindungen zusammengehalten. Bei dieser Bindungsart werden die Elektronen aller Atome angezogen und bilden ein kristallines Gitter, das fest bleibt. In den Bindungen des Kristallgitters sind alle Elektronen eingestreut und zum Transport von elektrischem Strom und Wärme eingerichtet wenn es ihnen übermittelt wird. Bei Übergangsmetallen ist diese Struktur der metallischen Bindungen bemerkenswerter, weil ihre Atome größer sind.
Beispiele für ionische Bindungen
Einige Substanzen mit ionischen Bindungen sind:
- NaCl-Natriumchlorid. Seine Ionen sind Na+ und Cl-.
- Kaliumchlorid KCl. Seine Ionen sind K+ und Cl-.
- Calciumchlorid CaCl2. Seine Ionen sind Ca+2 und Cl-.
- Magnesiumchlorid MgCl2. Seine Ionen sind Mg+2 und Cl-.
- Strontiumchlorid SrCl2. Seine Ionen sind Sr+2 und Cl-.
- Bariumchlorid BaCl2. Seine Ionen sind Ba+2 und Cl-.
- Aluminiumchlorid AlCl3. Seine Ionen sind Al+3 und Cl-.
- Na-Natriumsulfat2SW4. Seine Ionen sind Na+ Und so4-2.
- Kalium-K-Sulfat2SW4. Seine Ionen sind K+ Und so4-2.
- Calciumsulfat CaSO4. Seine Ionen sind Ca+2 Und so4-2.
- Calciumsulfat MgSO4. Seine Ionen sind Mg+2 Und so4-2.
- Strontiumsulfat SrSO4. Seine Ionen sind Sr+2 Und so4-2.
- Bariumsulfat BaSO4. Seine Ionen sind Ba+2 Und so4-2.
- Na-Natriumphosphat3Bestellung4. Seine Ionen sind Na+ und PO4-3.
- Kalium-K-Phosphat3Bestellung4. Seine Ionen sind K+ und PO4-3.
- Magnesiumphosphat Mg3(PO4)2. Seine Ionen sind Mg+2 und PO4-3.
- Calciumphosphat Ca3(PO4)2. Seine Ionen sind Ca+2 und PO4-3.
- Aluminiumphosphat AlPO4. Seine Ionen sind Al+3 und PO4-3.
- Eisenphosphat Fe3(PO4)2. Seine Ionen sind Fe+2 und PO4-3.
- Eisen(III)-phosphat FePO4. Seine Ionen sind Fe+3 und PO4-3.
Beispiele für kovalente Bindungen
Einige Substanzen, die kovalente Bindungen aufweisen, sind:
- Methan CH4.
- Ethan C2H6.
- Propan C3H8.
- Butan C4H10.
- Pentan C5H12.
- Hexan C6H14.
- Heptan C7H16.
- Oktan C8H18.
- Propylen CH2= CH2-CH3.
- Acetylen C2H2.
- Methylalkohol CH3
- Ethylalkohol C2H5
- Propylalkohol C3H7
- Isopropylalkohol CH3CH (OH) CH3.
- 2-Propanon oder Aceton CH3Wagen3.
- Formaldehyd HCHO.
- Acetaldehyd CH3
- Propionaldehyd CH3CH2
- Butyraldehyd CH3CH2CH2
- Ameisensäure HCOOH.
Beispiele für metallische Bindung
Einige Substanzen, die eine metallische Bindung aufweisen, sind:
- Zink Zn
- Cadmium Cd
- Kupfer Cu
- Silber Ag
- Gold-Au
- Nickel Ni
- Palladium Pd
- Platin Pt
- Kobalt Co
- Rhodium Rh
- Iridium Go
- Eisen Fe
- Ruthenium Ru
- Osmium-Os
- Mangan Mn
- Chrom Cr
- Molybdän Mo
- Wolfram W
- Vanadium V
- Zrconium Zr
Folge mit:
- Atome
- Ion
- Metalle
- Keine Metalle
- Alkane
- Lösungen


