Beispiel für Charles' Gesetz
Physik / / July 04, 2021
Das Gasgesetz von Charles oder das Gesetz des konstanten Drucks ist ein weiteres Gasgesetz. ausgesprochen von Gay-Lussac, der das Werk von Jacques Charles bekannt machte, erschienen um 20 vor Jahren.
Das Charlessche Gesetz sagt das Verhalten einer Gasmasse voraus, wenn der Druck konstant bleibt und die Temperatur und das Volumen variieren.
Das Gesetz von Charles lautet wie folgt:
Bei konstantem Druck ist das Volumen eines Gases direkt proportional zur Temperaturänderung.
Konstanter Druck: bezieht sich auf die Tatsache, dass der Druck, den das Gas auf die Wände des Behälters ausübt, während der gesamten Erfahrung nicht variiert.
Volumen: Es ist der vom Gas eingenommene Raum, im Allgemeinen wird er als ein Behälter mit nicht verformbaren Wänden betrachtet, dessen Deckel wie ein Kolben funktioniert.
Temperatur: Es ist die Zunahme oder der Verlust von Wärme, die das Gas während des Experiments erfährt. Steigt die Temperatur, erhöht sich die Lautstärke. Sinkt die Temperatur, nimmt auch die Lautstärke ab.
Algebraisch wird das Charlessche Gesetz mit der folgenden Formel ausgedrückt:

Wo:
V = Gasvolumen
T = Gastemperatur
k = Proportionalitätskonstante für diese Gasmasse.
Dies bedeutet, dass für eine gegebene Gasmasse bei konstantem Druck das Verhältnis zwischen Volumen und Temperaturschwankungen, haben immer die gleiche Proportionalitätsbeziehung, dargestellt durch die Konstante k:

Sobald die Konstante bestimmt ist, können wir jeden der anderen Werte aus den anderen bekannten Daten berechnen:
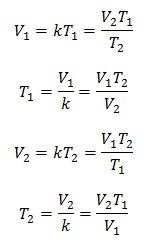
3 Beispiele für das Charlessche Gesetz auf Probleme angewendet:
Beispiel 1: Berechnen Sie das neue Volumen, wenn sich in einem Behälter eine Gasmasse befindet, die ein Volumen von 1,3 Litern bei einer Temperatur von 280 K einnimmt. Berechnen Sie das Volumen bei Erreichen einer Temperatur von 303 K.
V1 = 1,3 Liter.
T1 = 280 K
V2 = ?
T2 = 303 K
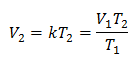
Ersetzende Werte:
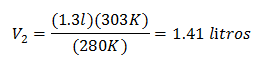
Das neue Volumen bei 303 K beträgt 1,41 Liter.
Beispiel 2. Wenn wir ein Gas haben, das bei 10 Grad Celsius 2,4 Liter einnimmt, berechnen Sie die Endtemperatur, wenn es am Ende 2,15 Liter einnimmt.
V1 = 2,4 l
T1 = 10 °C = 283 K
V2 = 2,15 l
T2 = ?
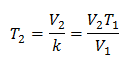
Ersetzende Werte:
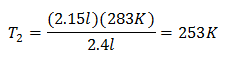
Die neue Temperatur beträgt 253 K, was -20 ° C entspricht.
Beispiel 3. Wir haben ein Gas mit einer Anfangstemperatur von 328 K, einem Endvolumen von 3,75 l und einer Verhältniskonstante von 0,00885.
V1 = ?
T1 = 328 K
V2 = 3,75 l
T2 = ?
k = 0,00885
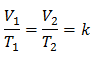
Ersetzende Werte:
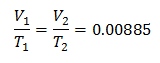
So erfahren Sie das Anfangsvolumen:
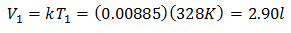
Das Ausgangsvolumen beträgt 2,90 l.
Um die Endtemperatur zu erfahren:
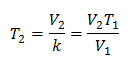
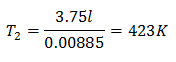
Die Endtemperatur beträgt 423 K, was 150 ° C entspricht.



