100 Παραδείγματα χημικών στοιχείων
Miscellanea / / November 13, 2021
ο χημικά στοιχεία είναι ένα είδος θέματος που χωρίς διαδικασία ή χημική αντίδραση μπορούν να μειωθούν ή να αποσυντεθούν σε άλλα απλούστερα στοιχεία. Για αυτόν τον λόγο, μπορεί να ειπωθεί ότι ένα στοιχείο είναι το παν ύλη φτιαγμένο από άτομα της ίδιας και μοναδικής τάξης, δηλαδή ατόμων που έχουν τον ίδιο ατομικό αριθμό (ίσος αριθμός πρωτονίων), αν και έχουν διαφορετική ατομική μάζα. Για παράδειγμα: θείο, βόριο, χρώμιο, κασσίτερος.
Ο πρώτος ορισμός ενός χημικού στοιχείου εισήχθη από τον Lavoisier στο Traité Élémentaire de Chimie, το 1789. Τον 18ο αιώνα, ο Lavoisier υποδιαίρεσε τις απλές ουσίες σε τέσσερις ομάδες:
Περιοδικός πίνακας στοιχείων
Σήμερα γνωρίζουν ο ένας τον άλλον 118 χημικά στοιχεία. Όλοι συγκεντρώνονται, ταξινομούνται και οργανώνονται σύμφωνα με πολλές από τις ιδιότητές τους σε ένα γραφικό σχήμα γνωστό ως Περιοδικός Πίνακας των Στοιχείων, ο οποίος δημιουργήθηκε αρχικά από τον Ρώσο χημικό Δημήτρη Μεντελέγιεφ το 1869. Ο Περιοδικός Πίνακας αποτελείται από 18 ομάδες (στήλες) και 7 περιόδους (σειρές), στις οποίες βρίσκονται τα χημικά στοιχεία.
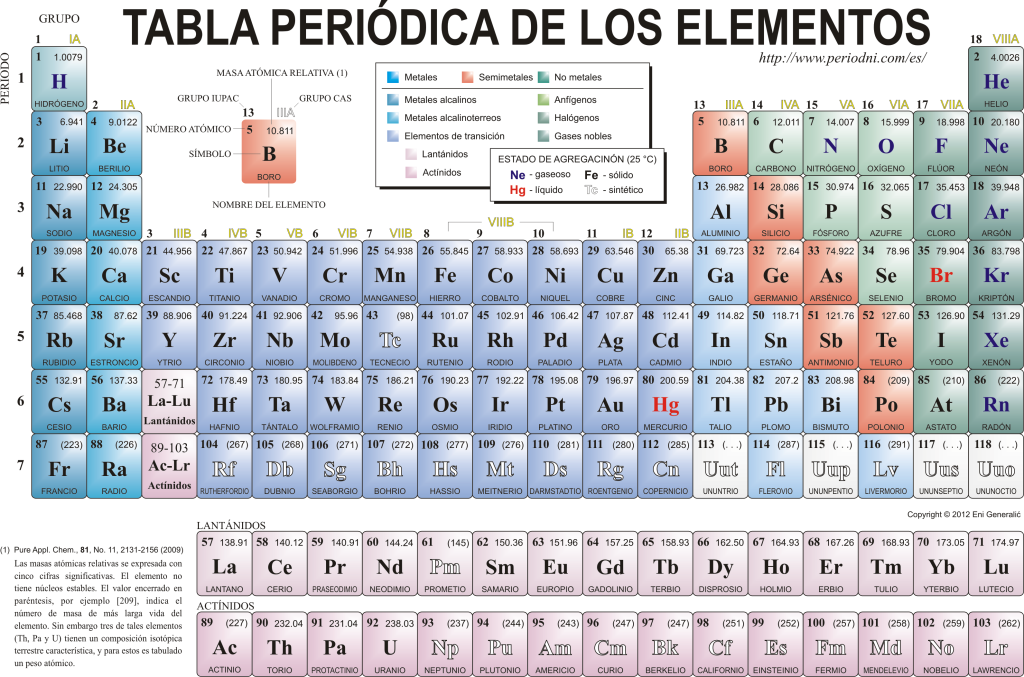
ο κύριες ομάδες που μπορείτε να βρείτε σε αυτόν τον πίνακα είναι:
Τα αλκαλικά μέταλλα (Ομάδα 1), τα μέταλλα αλκαλικών γαιών (Ομάδα 2), η οικογένεια σκανδίου, η οποία περιλαμβάνει τις γαίες και τα ακτινίδια (Ομάδα 3), την οικογένεια τιτανίου (Ομάδα 4), η οικογένεια βαναδίου (Ομάδα 5), η οικογένεια χρωμίου (Ομάδα 6), η οικογένεια μαγγανίου (Ομάδα 7), η οικογένεια σιδήρου (Ομάδα 8), η οικογένεια κοβαλτίου (Ομάδα 9), η οικογένεια νικελίου (ομάδα 10), η οικογένεια χαλκού (ομάδα 11), η οικογένεια ψευδαργύρου (ομάδα 12), τα στοιχεία γης (ομάδα 13), τα στοιχεία ανθρακιδίου, σε αυτήν την ομάδα είναι Ο άνθρακας, που είναι η βάση της ζωής στη Γη (Ομάδα 14), τα στοιχεία που σχηματίζουν άζωτο (Ομάδα 15), τα αμφιγενετικά στοιχεία, περιλαμβάνουν το οξυγόνο, ένα θεμελιώδες στοιχείο για ο αναπνοή απο ζωντανά όντα (Ομάδα 16), στοιχεία αλογόνου (Ομάδα 17) και ευγενή αέρια (Ομάδα 18).
Πολλά από αυτά τα στοιχεία έχουν σταθερά ή ραδιενεργά ισότοπα, δηλαδή, το ίδιο χημικό στοιχείο, για παράδειγμα, υδρογόνο (Η), μπορεί να έχει πολλά ισότοπα (1Η, 2Η, 3Η). Αυτό σημαίνει ότι κάθε άτομο ισότοπου έχει τον ίδιο αριθμό πρωτονίων (που σημαίνει ότι ανήκει στο ίδιο χημικό στοιχείο) και διαφορετικό αριθμό νετρονίων.
Μερικά ισότοπα δεν είναι σταθερά (ραδιενεργά), δηλαδή, αποσυνθέτω σε ένα ορισμένο χρονικό διάστημα, εκπέμποντας ορισμένα σωματίδια (νετρόνια, φωτόνια, σωματίδια άλφα, μεταξύ άλλων) και παράγοντας άλλα σταθερά ή ραδιενεργά ισότοπα. Τα χημικά στοιχεία έχουν ιδιότητες όπως το σημείο βρασμός και αυτό του σύντηξη, ηλεκτροαρνητικότητα, πυκνότητα και ιονική ακτίνα, μεταξύ άλλων. Αυτές οι ιδιότητες είναι σημαντικές επειδή μας επιτρέπουν να προβλέψουμε τη συμπεριφορά, την αντιδραστικότητα κ.λπ.
Πώς παρουσιάζονται τα στοιχεία στον Περιοδικό Πίνακα;
Κάθε χημικό στοιχείο χαρακτηρίζεται στο Περιοδικός Πίνακας χρησιμοποιώντας συγκεκριμένη συμβολογία. Πρώτον, στο κέντρο κάθε τετραγώνου το καθολικό του σύμβολο, το οποίο αποτελείται από ένα ή δύο γράμματα (κατά σύμβαση, εάν υπάρχουν δύο γράμματα, το πρώτο είναι γραμμένο με κεφαλαία και το επόμενο με πεζά).
Πάνω και προς τα αριστερά εμφανίζεται στο μικρό γραμματοσειρά su ατομικός αριθμός, που είναι αυτό που δείχνει την ποσότητα των πρωτονίων που έχει αυτό το στοιχείο. Κάτω από το σύμβολο του στοιχείου εμφανίζεται το όνομά του και πάνω, στα αριστερά, εμφανίζεται το όνομά του. ατομική μάζα συγγενής. Επιπλέον, το χρώμα στο οποίο αναπαριστάται το σύμβολο του στοιχείου δηλώνει την κατάσταση του συνάθροισης (σύμφωνα με την αναπαράσταση που χρησιμοποιείται σε κάθε Περιοδικό Πίνακα).
Τα διαφορετικά στοιχεία υπάρχουν ατομικές ακτίνες μεταβλητές και, καθώς ο αριθμός των πρωτονίων στον πυρήνα αυξάνεται, τόσο μεγαλύτερη είναι η έλξη που ασκεί ο πυρήνας στα ηλεκτρόνια, έτσι η ατομική ακτίνα τείνει να μειώνεται. Όταν η ατομική ακτίνα είναι μικρή, τα ηλεκτρόνια στο εξώτατο επίπεδο του νέφους προσελκύονται πολύ στον πυρήνα, οπότε δεν εγκαταλείπουν εύκολα. Το αντίθετο συμβαίνει με στοιχεία με υψηλές ατομικές ακτίνες: εγκαταλείπουν εύκολα τα εξωτερικά τους ηλεκτρόνια.
Έτσι, η ατομική ακτίνα αυξάνεται από πάνω προς τα κάτω όταν περνάμε από τις ομάδες του Περιοδικού Πίνακα και μειώνεται από αριστερά προς τα δεξιά καθώς περνάμε τις περιόδους τους.
Παραδείγματα χημικών στοιχείων
| Χημικό στοιχείο | Σύμβολο |
| Ακτίνιο | Μετα Χριστον |
| Αλουμίνιο | Στο |
| Αμερίκιο | ΕΙΜΑΙ |
| Αντιμόνιο | Sb |
| Αργόν | Αρ |
| Αρσενικό | Ασσος |
| Άστατ | Στο |
| Θείο | μικρό |
| Βάριο | Μπα |
| Βηρύλλιο | Είναι |
| Μπέρκλεϊ | Μπακ |
| Βισμούθιο | Μπι |
| Μποχριό | Μπαχ |
| Βόριο | σι |
| Βρώμιο | Μπρ |
| Κάδμιο | CD |
| Ασβέστιο | ΜΕΤΑ ΧΡΙΣΤΟΝ |
| Καλιφόρνιο | Πρβλ |
| Ανθρακας | ντο |
| Δημήτριο | EC |
| Καίσιο | Cs |
| Χλώριο | Κλ |
| Κοβάλτιο | Συνεργάτης |
| Χαλκός | Κου |
| Χρώμιο | Κρ |
| Κούριο | Εκ |
| Ντάρμσταντιο | Δδ |
| Dysprosium | Ντυ |
| Ντουμπίνιο | Δβ |
| Αϊντινίνιο | είναι |
| Ερβιο | Ερ |
| Σκάνδιο | Sc |
| Κασσίτερος | Σιν |
| Στρόντιο | κύριος |
| Ευρώπιο | ΕΕ |
| Φέρμιο | Φμ |
| Φθόριο | φά |
| Αγώνας | Π |
| Φράνκις | Πρ |
| Γαδολίνιο | Gd |
| Γάλλιο | Γα |
| Γερμάνιο | Τζ |
| Αφνιο | Χφ |
| Χάσιο | Ω |
| Ήλιο | έχω |
| Υδρογόνο | Η |
| Σίδερο | Πίστη |
| Χόλιο | Χο |
| Ινδός | Σε |
| Ιώδιο | Εγώ |
| Ιρίδιο | Να πάω |
| Υττερβίο | Yb |
| Υττριο | Γ |
| Κρυπτόν | Κρ |
| Λανθάνιο | ο |
| Λόρεντσιο | Γρ |
| Λίθιο | Λι |
| Λουτέτιο | Δευ |
| Μαγνήσιο | Π.χ. |
| Μαγγάνιο | Μη |
| Meitnerius | Όρος |
| Μεντελέβιο | Δρ |
| Ερμής | Hg |
| Μολυβδαίνιο | Μω |
| Νεοδύμιο | ΝΑ |
| Νέο | Νε |
| Ποσειδώνιο | Νρ |
| Νιόβιο | Σημ |
| Νικέλιο | κανενα απο τα δυο |
| Αζωτο | Ν |
| Νόμπελι | Δεν |
| Χρυσός | Ω |
| Ωσμίο | Εσείς |
| Οξυγόνο | Ή |
| Παλλάδιο | ΥΣΤΕΡΟΓΡΑΦΟ |
| Ασήμι | Αγ |
| Πλατίνα | Π.Τ. |
| Οδηγω | Pb |
| Πλουτώνιο | Που |
| Πολώνιο | Ταχυδρομείο |
| Κάλιο | κ |
| Πρασεοδύμιο | Πρ |
| Υπόσχεση | Μετα μεσημβριας |
| Πρωτακτίνιο | Πα |
| Ραδιόφωνο | Ρα |
| Ραδόνιο | Ρν |
| Ρήνιο | Σχετικά με |
| Ρόδιο | Rh |
| Ρουβίνιο | Rb |
| Ρουθήνιο | Ρου |
| Ράδερφορντιο | Rf |
| Σαμάριο | Εσείς |
| Σεβέργιο | Αρ |
| Σελήνιο | Ξέρω |
| Πυρίτιο | Ναί |
| Νάτριο | ΝΑ |
| Θάλλιο | Τλ |
| Ταντάλιο | Τα |
| Τεχνήτιο | Τηλε |
| Τελλούριο | Τσάι |
| Τέρβιο | Τιμ |
| Τιτάνιο | Εσείς |
| Θόριο | Θ |
| Θούλιο | Τιμ |
| Κοπέρνικος | Cn |
| Livermorio | Λβ |
| Ροέντζενιο | Rg |
| Ουνόκτιο | Γιούο |
| Unpentium | Ωχ |
| Φλέροβιο | Φλ |
| Unsseptio | Ούς |
| Ununtrium | Ουτ |
| Ουράνιο | Ή |
| Βανάδιο | Β |
| Βολφράμιο | Δ |
| Ξένο | Χε |
| Ψευδάργυρος | Ζν |
| Ζιρκόνιο | Ζρ |

Ακολουθήστε με:

