50 Παραδείγματα Αλδεΰδων και Κετόνων
Παραδείγματα / / November 06, 2023
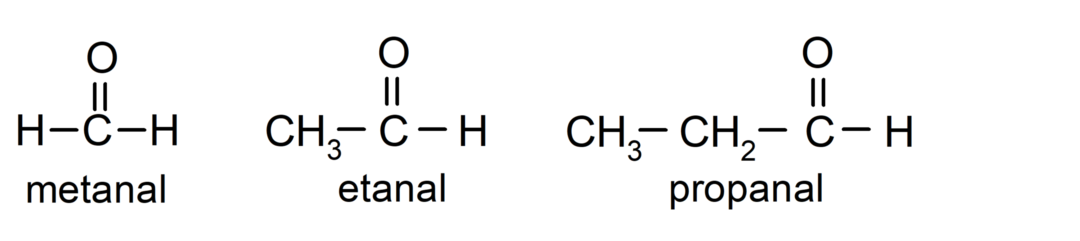
ο αλδεΰδες είναι ΟΡΓΑΝΙΚΕΣ ΕΝΩΣΕΙΣ που έχουν στη δομή τους μια λειτουργική ομάδα καρβονυλίου (= C = O) που συνδέεται με μια ανθρακική αλυσίδα και ένα άτομο υδρογόνου. Για παράδειγμα: μεθανάλη (ονομάζεται επίσης φορμαλδεΰδη), αιθανάλη (ονομάζεται επίσης ακεταλδεΰδη) και προπανάλη (ονομάζεται επίσης προπαλδεΰδη).
ο κετόνες Είναι οργανικές ενώσεις που έχουν στη δομή τους μια καρβονυλ ομάδα συνδεδεμένη με δύο άτομα άνθρακα. Για παράδειγμα: προπανόνη (ονομάζεται επίσης ακετόνη), βουτανόνη και 2-πεντανόνη.
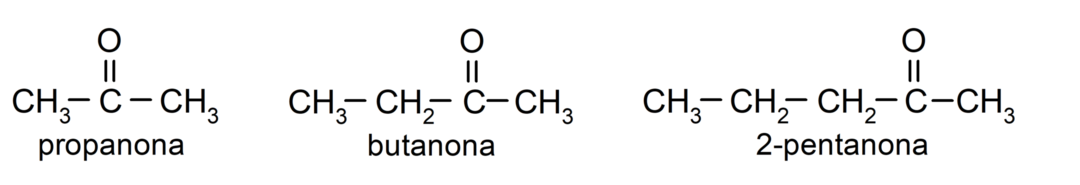
Διαφορές μεταξύ αλδεΰδων και κετονών
Οι κύριες διαφορές μεταξύ αλδεΰδων και κετονών είναι:
- Οι αλδεΰδες έχουν στη δομή τους μια λειτουργική ομάδα καρβονυλίου που βρίσκεται στο ένα τερματικό άκρο, ενώ οι κετόνες έχουν την καρβονυλική ομάδα που βρίσκεται σε μη τελικές θέσεις τους δομή.
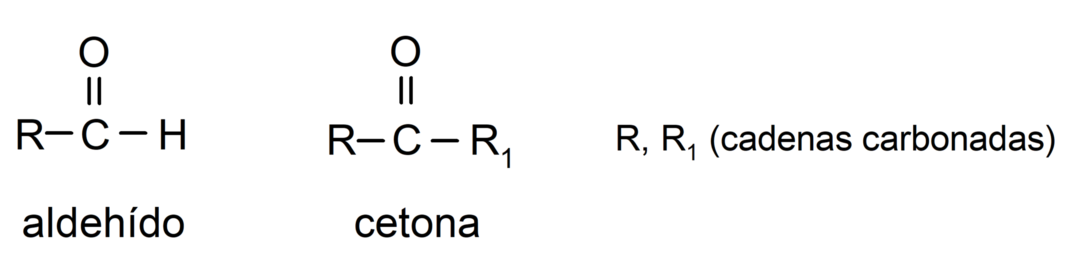
- Οι αλδεΰδες οξειδώνονται με αντίδραση με το αντιδραστήριο Tollens, σχηματίζοντας μεταλλικό άργυρο. Επίσης οξειδώνονται έναντι του αντιδραστηρίου Benedict, σχηματίζοντας οξείδιο του χαλκού. Οι κετόνες δεν οξειδώνονται από κανένα από τα δύο αντιδραστήρια.
- Οι αλδεΰδες ανάγεται σε πρωτοταγείς αλκοόλες, ενώ οι κετόνες σε δευτεροταγείς αλκοόλες.
Φυσικές ιδιότητες
Φυσικές ιδιότητες των αλδεΰδων
Οι φυσικές ιδιότητες των αλδεΰδων είναι πολύ διαφορετικές επειδή εξαρτώνται από τη σύσταση της ανθρακικής αλυσίδας που συνδέεται με την καρβονυλ ομάδα.
Μερικοι ειναι:
- Οι αλδεΰδες που είναι πιο διαλυτές στο νερό είναι αυτές που έχουν μικρότερο μέγεθος, όπως η μεθανάλη και η αιθανάλη.
- Οι πτητικές αλδεΰδες έχουν έντονες και ακόμη και ερεθιστικές οσμές.
- Η καρβονυλική ομάδα τους δίνει πολικότητα.
- Συνήθως έχουν υψηλότερα σημεία βρασμού από χημικές ενώσεις παρόμοιου μοριακού μεγέθους.
Φυσικές ιδιότητες των κετονών
Οι φυσικές ιδιότητες των κετονών εξαρτώνται από το πώς σχηματίζεται η ανθρακική αλυσίδα που συνδέεται με την καρβονυλ ομάδα.
- Πολλές κετόνες έχουν ευχάριστες οσμές.
- Η διαλυτότητά του στο νερό εξαρτάται από το μέγεθος της ανθρακικής αλυσίδας που συνδέεται με την καρβονυλική ομάδα. Όσο μικρότερη είναι η ανθρακική αλυσίδα, τόσο πιο διαλυτή θα είναι η κετόνη στο νερό.
- Η καρβονυλική ομάδα τους δίνει μια αξιοσημείωτη πολικότητα.
- Έχουν αρκετά υψηλά σημεία βρασμού σε σύγκριση με χημικές ενώσεις συγκρίσιμου μοριακού μεγέθους.
Χημικές ιδιότητες
Χημικές ιδιότητες των αλδεΰδων
Μεταξύ των χημικών ιδιοτήτων των αλδεΰδων μπορούμε να βρούμε:
Οξειδώνονται για να σχηματίσουν το αντίστοιχο καρβοξυλικό οξύ, δηλαδή, το οξύ που σχηματίζεται θα έχει τον ίδιο αριθμό ανθράκων στην ανθρακική αλυσίδα με το αλδεγύδη που το γέννησε. Για παράδειγμα:
- Οξείδωση με αντιδραστήριο Tollens (σύμπλοκο αμμωνιακού αργύρου σε βασικό διάλυμα, [Ag (NH3)2]+) από την αιθανάλη παράγει αιθανοϊκό οξύ και μεταλλικό άργυρο.
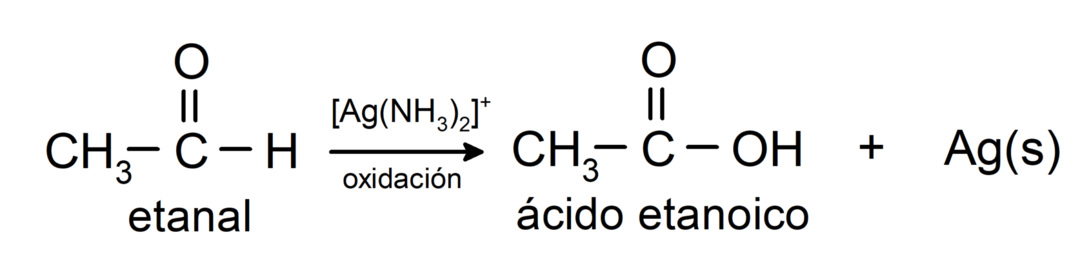
- Η οξείδωση με αντιδραστήριο Benedict (αλκαλικό διάλυμα θειικού χαλκού) αιθανάλης παράγει αιθανικό οξύ και οξείδιο του χαλκού.
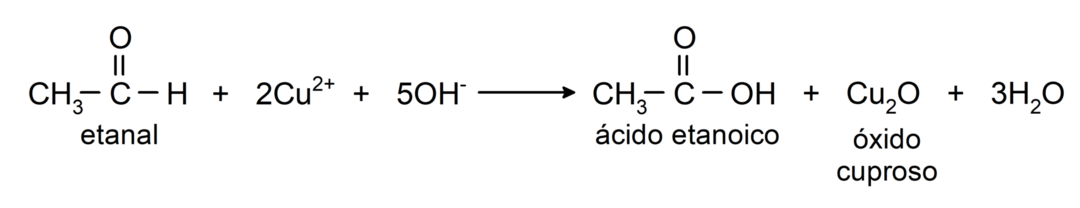
Υποβάλλονται σε πυρηνόφιλες αντιδράσεις προσθήκης, δηλαδή προσθήκη πυρηνόφιλου στην καρβονυλ ομάδα. Για παράδειγμα:
- Προσθήκη υδροκυανικού οξέος για σχηματισμό κυανοϋδρινών ή κυανοϋδρινών.
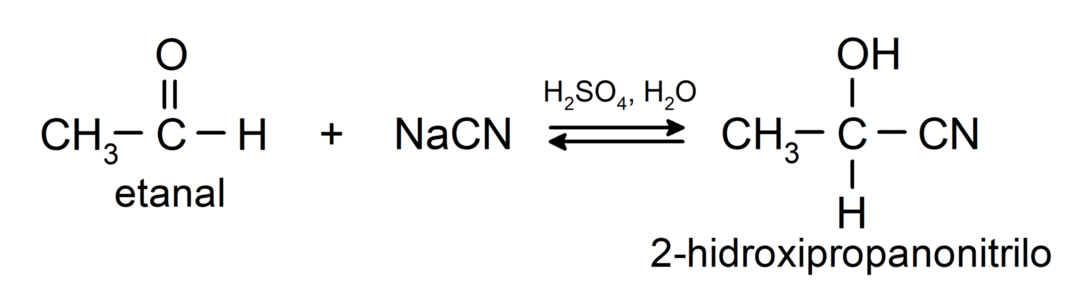
- Παρουσία ανύδρων οξέων, αλκοόλες προστίθενται στην καρβονυλική ομάδα των αλδεΰδων για να σχηματιστούν ακετάλες και ημιακετάλες.
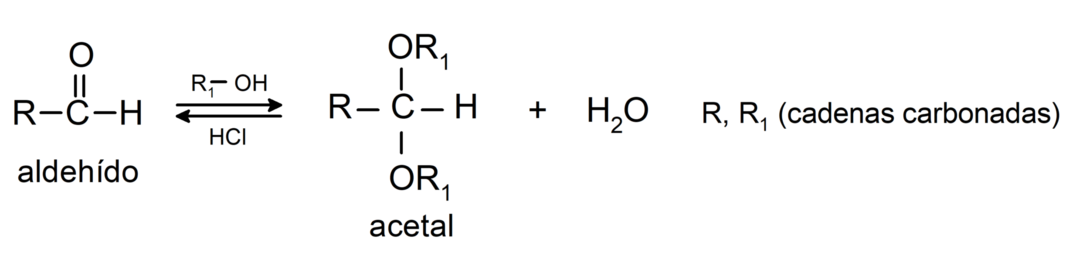
Υποβάλλονται σε αντιδράσεις συμπύκνωσης αλδόλης. Σε αυτές τις αντιδράσεις, η ένωση δύο αλδεΰδων συμβαίνει παρουσία υδροξειδίου του νατρίου (NaOH) και του χημική ένωση που προκύπτει ονομάζεται αλδόλ. Για παράδειγμα:
- Αντίδραση συμπύκνωσης αιθανάλης παρουσία αραιωμένου NaOH.
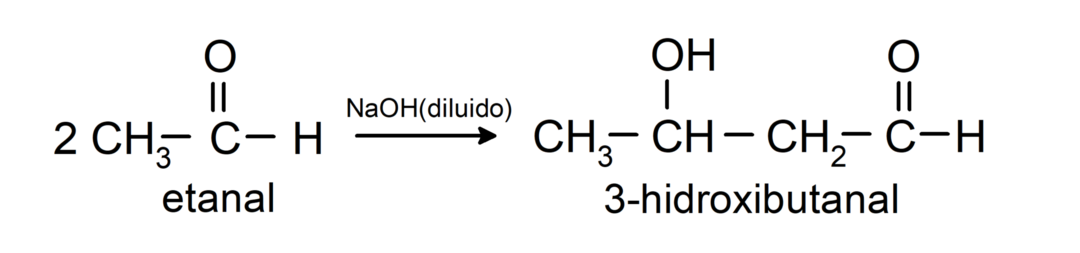
Ανάγεται σε πρωτογενείς αλκοόλες. Οι αλδεΰδες μπορούν να αναχθούν σε πρωτοταγείς αλκοόλες με καταλυτική υδρογόνωση ή με αναγωγή με βοριοϋδρίδιο του νατρίου (NaBH).4) και υδρίδιο λιθίου αργιλίου (LiAlH4).
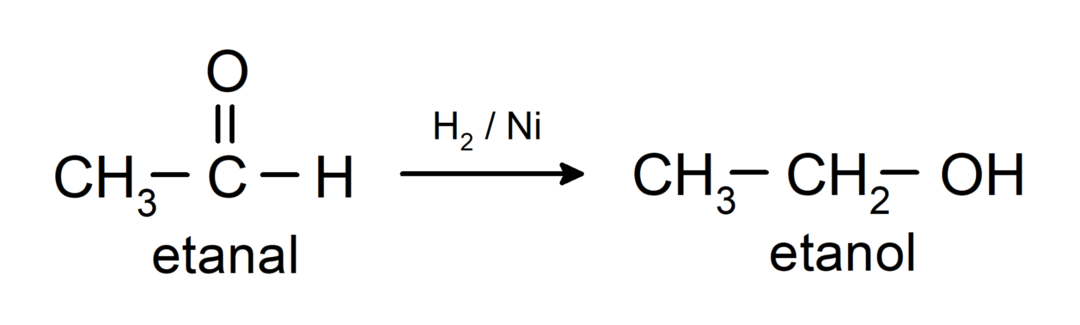
Χημικές ιδιότητες κετονών
Μεταξύ των χημικών ιδιοτήτων των κετονών μπορούμε να βρούμε:
Υποβάλλονται σε πυρηνόφιλες αντιδράσεις προσθήκης. Για παράδειγμα:
- Προσθήκη υδροκυανικού οξέος για σχηματισμό κυανοϋδρινών ή κυανοϋδρινών.
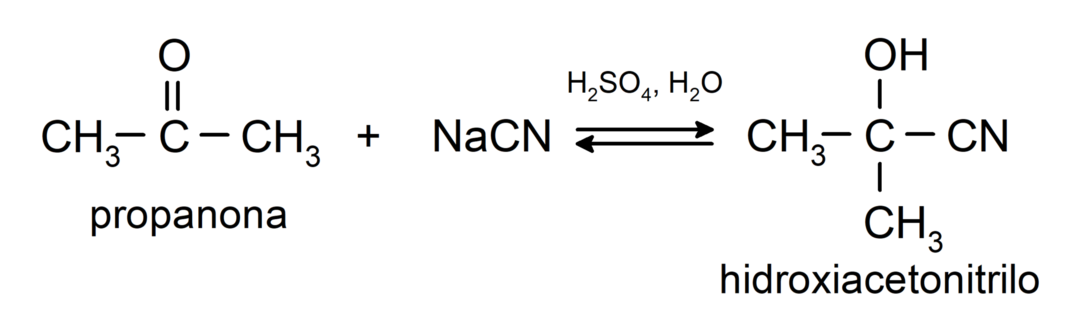
Προσθέτουν αλκοόλες (παρουσία ανύδρων οξέων) στην καρβονυλική ομάδα των κετονών για να σχηματιστούν κετάλες και ημικετάλες. Για παράδειγμα:
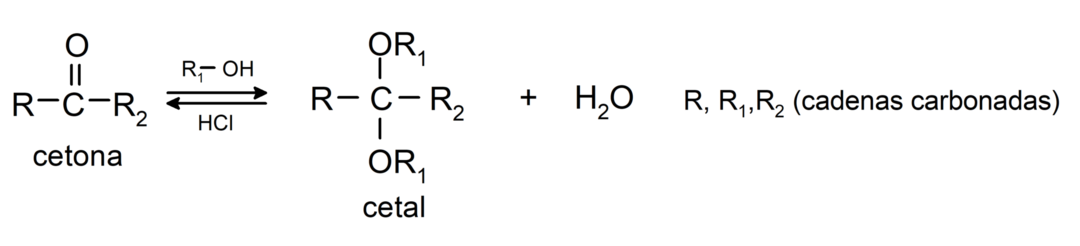
Υποβάλλονται σε αντιδράσεις αλογόνωσης. Κετόνες που έχουν άλφα υδρογόνο (α) αντιδρούν αντικαθιστώντας αυτό το υδρογόνο με αλογόνα (χλώριο (Cl), βρώμιο (Br), ιώδιο (I), φθόριο (F)) παρουσία όξινων ή βασικών καταλυτών. Η υποκατάσταση συμβαίνει σχεδόν αποκλειστικά στον άνθρακα α, δηλαδή ο άνθρακας που έχει συνδεθεί με το υδρογόνο α. Για παράδειγμα:
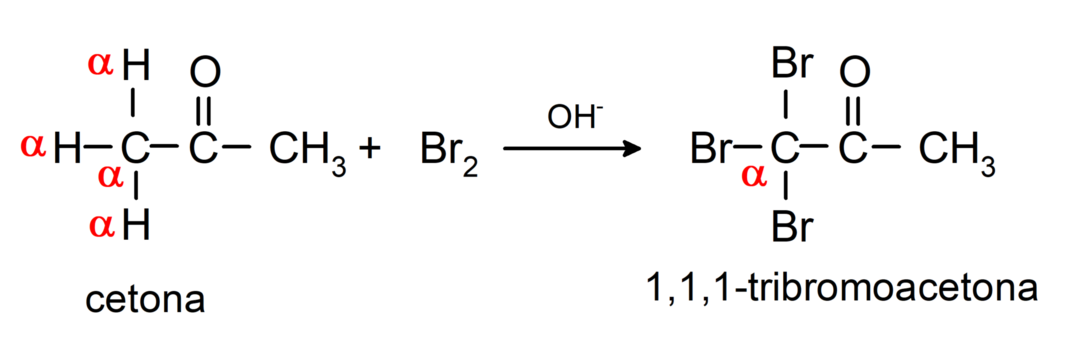
Ανάγεται σε δευτεροταγείς αλκοόλες με καταλυτική υδρογόνωση ή με αναγωγή με βοριοϋδρίδιο του νατρίου (NaBH4) και υδρίδιο λιθίου αργιλίου (LiAlH4). Για παράδειγμα:
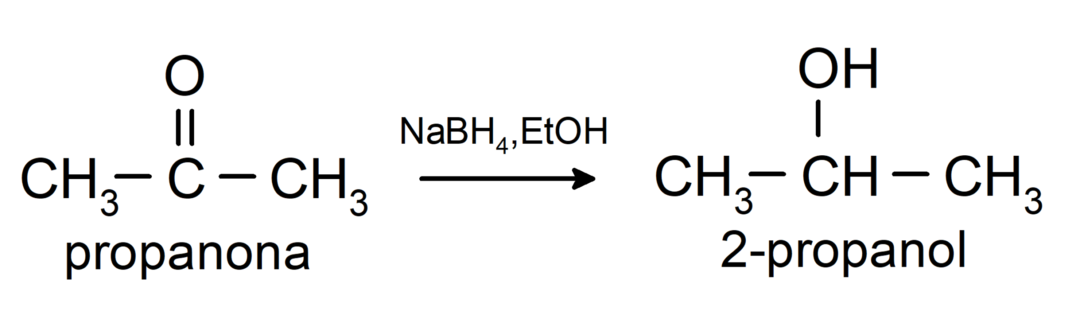
Οι κετόνες δεν οξειδώνονται από τα αντιδραστήρια Tollens και Benedict.
Ονοματολογία αλδεΰδων
Σύμφωνα με τους κανόνες που έχει θεσπίσει η Διεθνής Ένωση Καθαρής και Εφαρμοσμένης Χημείας (IUPAC), Οι αλδεΰδες ονομάζονται χρησιμοποιώντας προθέματα που υποδεικνύουν τον αριθμό των ανθράκων στην αλυσίδα. ανθρακούχο. Δεν είναι απαραίτητο να προσδιοριστεί η θέση της ομάδας καρβονυλίου, καθώς βρίσκεται πάντα στη θέση ένα, στο ένα άκρο του μορίου. Επιπλέον, το επίθημα -al γράφεται στο τέλος του ονόματος της αλδεΰδης. Για παράδειγμα:
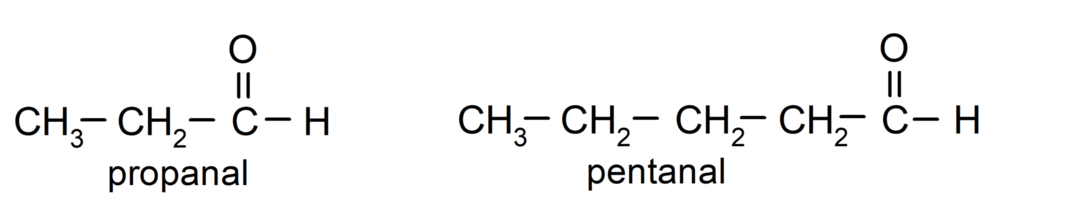
Εάν η αλδεΰδη αποτελείται από πολλές ανθρακικές αλυσίδες, δηλαδή έχει κλάδους, η ανθρακική αλυσίδα με τον μεγαλύτερο αριθμό ατόμων άνθρακα επιλέγεται ως κύρια αλυσίδα. Οι άλλες αλυσίδες ονομάζονται ως ομάδες υποκαταστατών και η θέση κάθε υποκαταστάτη επιλέγεται έτσι ώστε να καταλαμβάνει τον μικρότερο δυνατό αριθμό στην αλυσίδα. Επιπλέον, τα άτομα άνθρακα αρχίζουν να μετρώνται ξεκινώντας από το άκρο που έχει την ομάδα καρβονυλίου. Για παράδειγμα:
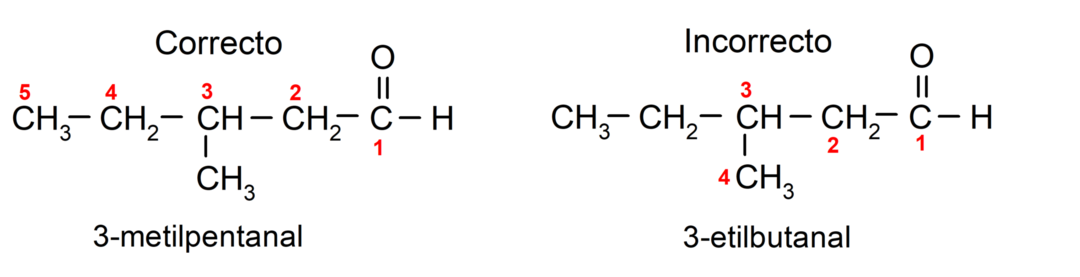
Οι αλδεΰδες που έχουν δύο ομάδες καρβονυλίου ονομάζονται χρησιμοποιώντας το επίθημα -dial. Για παράδειγμα:
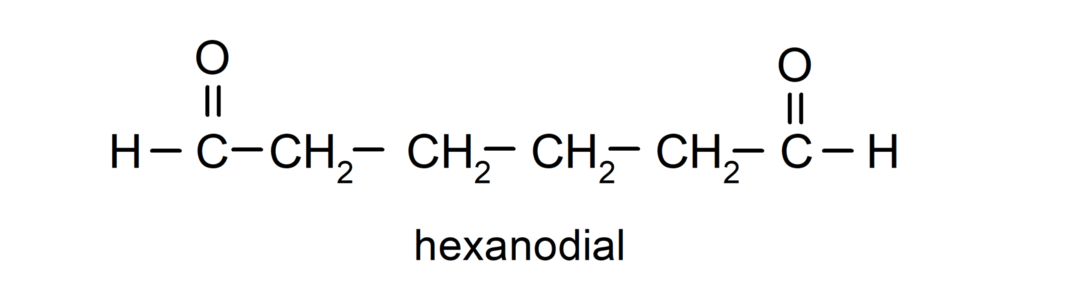
Ονοματολογία κετονών
Σύμφωνα με τη Διεθνή Ένωση Καθαρής και Εφαρμοσμένης Χημείας (IUPAC), οι κετόνες ονομάζονται χρησιμοποιώντας προθέματα που υποδεικνύουν τον αριθμό των ανθράκων στην ανθρακική αλυσίδα.
Από την άλλη πλευρά, το όνομα της ακετόνης γράφεται χρησιμοποιώντας το επίθημα -one, πριν από έναν αριθμό που υποδεικνύει τη θέση της ομάδας καρβονυλίου στην ανθρακική αλυσίδα. Η θέση της ομάδας καρβονυλίου πρέπει να επιλέγεται με τέτοιο τρόπο ώστε να αντιστοιχεί στη χαμηλότερη δυνατή αρίθμηση. Για παράδειγμα:
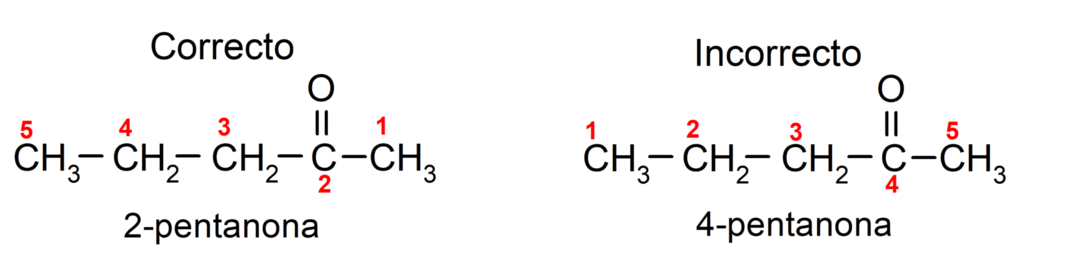
Για να ονομάσουμε μια κετόνη που αποτελείται από πολλές αλυσίδες άνθρακα, δηλαδή με κλαδιά, επιλέγουμε ως κύρια αλυσίδα, η ανθρακική αλυσίδα με τον μεγαλύτερο αριθμό ατόμων άνθρακα και που περιέχει την ομάδα καρβονυλ. Οι υπόλοιπες αλυσίδες ονομάζονται ως υποκαταστάτες ομάδες. Για παράδειγμα:
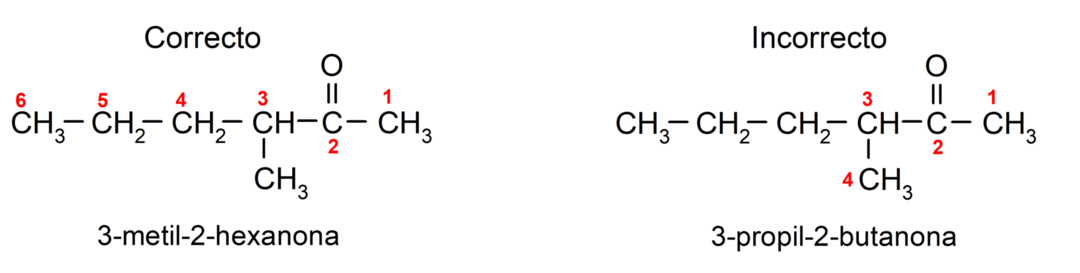
Υπάρχουν κετόνες που έχουν δύο καρβονυλικές ομάδες, ονομάζονται διόνες. Για παράδειγμα:
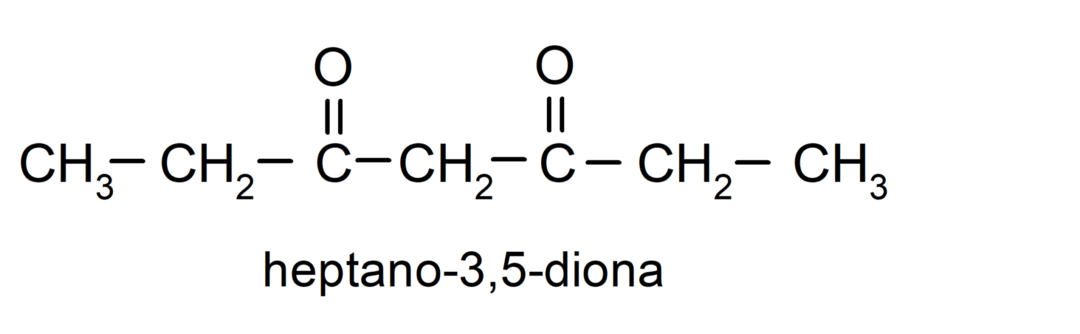
Παραδείγματα αλδεΰδων
- μεθανάλη (φορμαλδεΰδη)
- αιθανάλη (ακεταλδεΰδη)
- προπανάλη (προπαλδεΰδη)
- βουτανάλη
- πεντάλ
- εξανάλη
- 3-βρωμοκυκλοπεντανοκαρβαλδεΰδη
- κυκλοεξανοκαρβαλδεΰδη
- βενζαλδεΰδη
- 4,4-διμεθυλοπεντανάλη
- 2-υδροξυ-βουτανάλη
- 2-υδροξυ-2-μεθυλ-βουτανάλη
- 2,3-διμεθυλοπεντανάλη
- πεντάδικο
- 4-υδροξυ-3-μεθοξυβενζαλδεΰδη
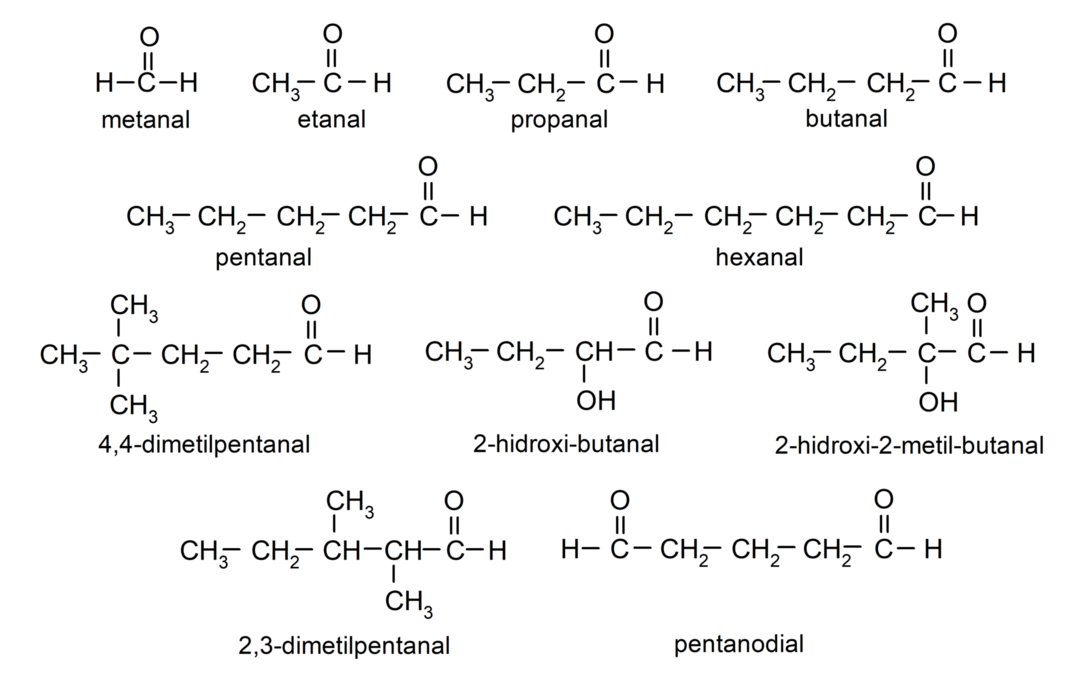
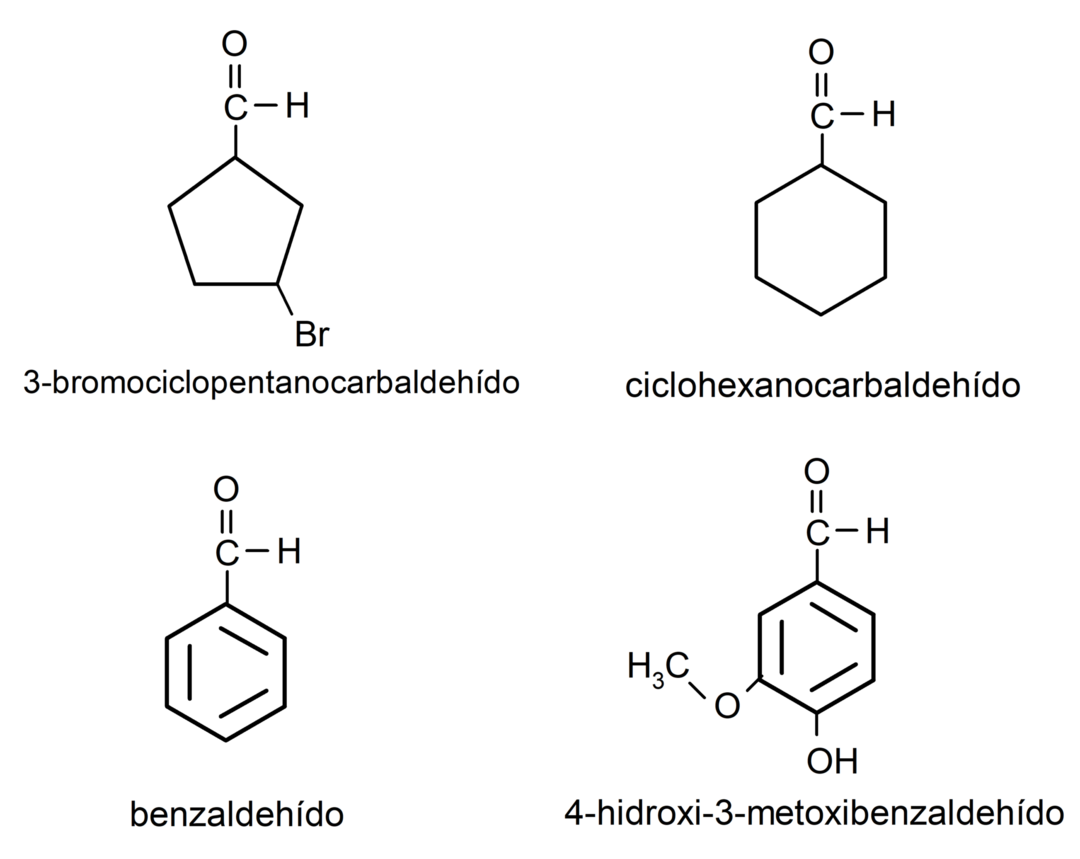
Παραδείγματα κετονών
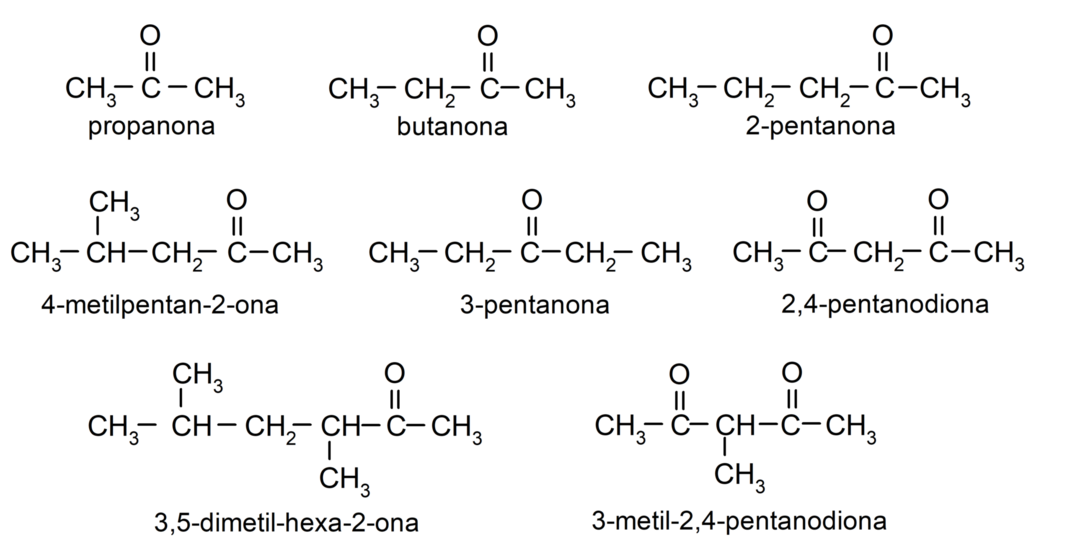
- προπανόνη (ακετόνη)
- βουτανόνη
- 2-πεντανόνη
- 4-μεθυλπενταν-2-όνη
- 3-μεθυλοκυκλοεξανόνη
- κυκλοεξυλομεθυλοκετόνη
- 3,4 διμεθυλ-εξαν-2-όνη
- αιθυλοφαινυλκετόνη
- 2,4-πεντανεδιόνη
- κυκλοεξανόνη
- 3-πεντανόνη
- 3-μεθυλ-2,4-πεντανεδιόνη
- 1-φαινυλοπροπανόνη
- κυκλοπεντανόνη
- διφαινυλοκετόνη
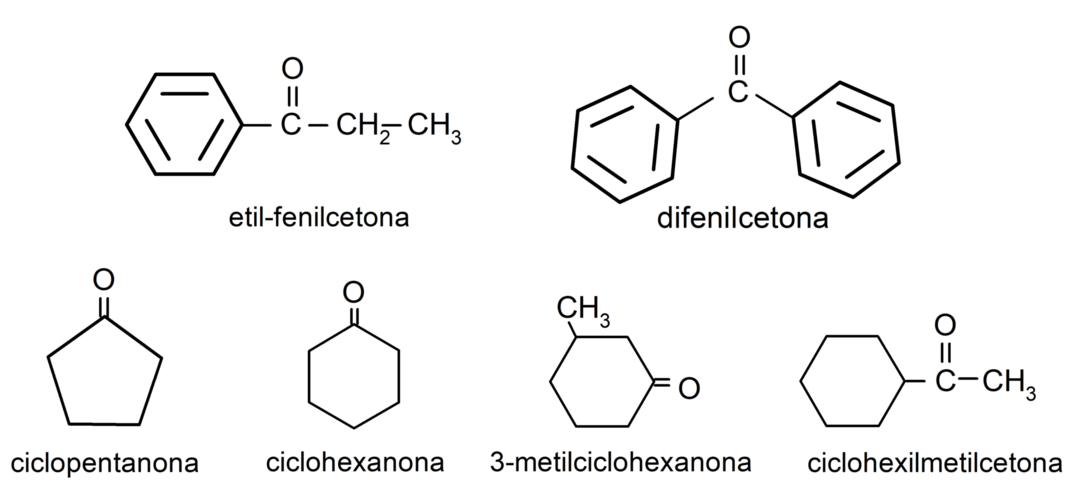
Χρήσεις αλδεΰδων στην καθημερινή ζωή
Μερικές χρήσεις των αλδεΰδων είναι:
- Χρησιμοποιούνται για την παραγωγή διαλυτών, χρωμάτων, αρωμάτων, ρητινών και αιθέριων ουσιών.
- Χρησιμοποιούνται ως συντηρητικά σε καλλυντικά προϊόντα, βιολογικά δείγματα και πτώματα. Η φορμαλδεΰδη είναι η πιο χρησιμοποιούμενη για αυτούς τους σκοπούς.
- Χρησιμοποιούνται για την παραγωγή πλαστικών, τα οποία επιτρέπουν την αντικατάσταση μεταλλικών εξαρτημάτων στην αυτοκινητοβιομηχανία.
- Χρησιμοποιούνται ως αρώματα για ορισμένα τρόφιμα.
- Χρησιμοποιούνται ως απολυμαντικά μέσα.
- Έχουν χρησιμοποιηθεί για την παρασκευή ορισμένων εκρηκτικών, όπως η τετρανιτρική πενταερυθριτόλη (TNPE).
Χρήσεις κετονών στην καθημερινή ζωή
Μερικές χρήσεις των κετονών είναι:
- Χρησιμοποιούνται στην παραγωγή διαλυτών. Ειδικά το ασετόν χρησιμοποιείται ευρέως για την αφαίρεση χρωμάτων και βερνικιών.
- Χρησιμοποιούνται στην κατασκευή κάποιων καουτσούκ και λιπαντικών.
- Χρησιμοποιούνται για την παραγωγή χρωμάτων, βερνικιών και βερνικιών.
- Χρησιμοποιούνται για την παραγωγή φαρμάκων και καλλυντικών.
Τοξικότητα αλδεΰδης και κετόνης
- Οι αλδεΰδες. Η επαφή με αλδεΰδες προκαλεί ερεθισμό στο δέρμα, τα μάτια και την αναπνευστική οδό. Επιπλέον, η έκθεση σε αλδεΰδες έχει συνδεθεί με ασθένειες όπως ο καρκίνος, η δερματίτιδα εξ επαφής και οι ηπατικές και νευροεκφυλιστικές ασθένειες. Η φορμαλδεΰδη, για παράδειγμα, θεωρείται από τον ΠΟΥ (Παγκόσμιος Οργανισμός Υγείας) ως καρκινογόνος ένωση.
- κετόνες. Η επανειλημμένη έκθεση σε κετόνες μπορεί να προκαλέσει βλάβη στο κεντρικό νευρικό σύστημα. Αυτό μπορεί να οδηγήσει σε απώλεια μνήμης, αδυναμία, μυϊκούς πόνους και κράμπες. Επιπλέον, εάν το δέρμα έρθει σε επαφή με κετόνες, εμφανίζεται ξηρότητα και ρωγμές. Από την άλλη πλευρά, εάν εισπνέονται κετόνες, εμφανίζεται ερεθισμός της αναπνευστικής οδού και βήχας.
βιβλιογραφικές αναφορές
- Llorens Molina, JA. (2018). “Αλδεΰδες και κετόνες: Μερικά παραδείγματα.” http://hdl.handle.net/
- Gabriel Pinto Cañón, Manuela Martín Sánchez, José María Hernández Hernández, María Teresa Martín Sánchez (2015)Το αντιδραστήριο Tollens: από την αναγνώριση των αλδεΰδων στη χρήση τους στη νανοτεχνολογία. Ιστορικές όψεις και διδακτικές εφαρμογές.«Τόμ. 111 Αρ. 3. Βασιλική Ισπανική Εταιρεία Χημείας.
- William Bauer, Jr. (2000) «Μεθακρυλικό οξύ και παράγωγα» στο Ullmann’s Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. DOI: 10.1002/14356007.a16_441.
- «Αποκαλύπτουν έναν νέο μηχανισμό τοξικότητας σε μια ομάδα καρκινογόνων ενώσεων που προέρχονται από τη διατροφή και το περιβάλλον» (2022) Στο: www.conicet.gov.ar Διαθέσιμο σε: https://www.conicet.gov.ar/ Πρόσβαση: 20 Ιουνίου 2023.
Ακολουθήστε με:
- Αλκοόλ
- σάκχαρα
- Αλκάνια