30 Παραδείγματα Αλδεΰδων
Παραδείγματα / / November 06, 2023
ο αλδεΰδες είναι ΟΡΓΑΝΙΚΕΣ ΕΝΩΣΕΙΣ τα οποία σχηματίζονται από μια αλυσίδα άνθρακα που έχει μια τερματική ομάδα καρβονυλίου (= C = O) συνδεδεμένη (βρίσκεται στο ένα άκρο του μόριο), το οποίο με τη σειρά του συνδέεται με ένα άτομο υδρογόνου.
Πολύ κοινές αλδεΰδες είναι η μεθανάλη (φορμαλδεΰδη), η αιθανάλη (ακεταλδεΰδη) και η προπανάλη (προπαλδεΰδη).

Μερικές από αυτές τις ενώσεις υπάρχουν στη φύση, για παράδειγμα, η βανιλίνη ή η βανιλίνη είναι μια φυσική αλδεΰδη που αποτελεί το κύριο άρωμα της βανίλιας.
- Δείτε επίσης: Αλδεΰδες και κετόνες
Ονοματολογία αλδεΰδων
Οι αλδεΰδες μπορούν να ονομαστούν χρησιμοποιώντας τους κανόνες ονοματολογίας που έχουν θεσπιστεί από τη Διεθνή Ένωση Καθαρής και Εφαρμοσμένης Χημείας (IUPAC).
Για την ονομασία μιας αλδεΰδης, χρησιμοποιούνται προθέματα που υποδεικνύουν τον αριθμό των ατόμων άνθρακα που έχει προσκολλήσει η ανθρακική αλυσίδα στην καρβονυλική ομάδα. Η ομάδα καρβονυλίου βρίσκεται πάντα στο ένα άκρο της ανθρακικής αλυσίδας, πράγμα που σημαίνει ότι θα έχει πάντα τη θέση ένα και δεν είναι απαραίτητο να υποδεικνύεται η θέση της στην αλυσίδα. Επιπλέον, το επίθημα -al τοποθετείται στο τέλος του ονόματος της αλδεΰδης. Μερικά παραδείγματα είναι:
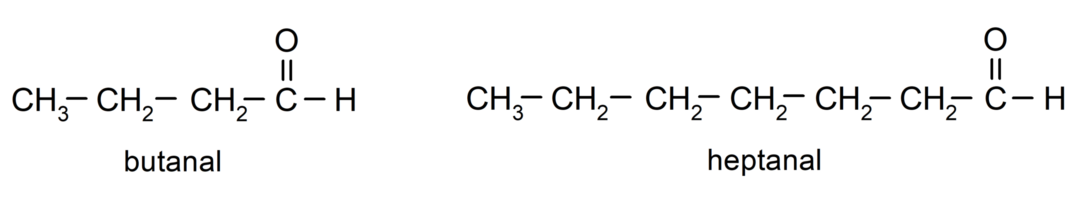
Εάν η αλδεΰδη είναι διακλαδισμένη, δηλαδή αποτελείται από πολλές αλυσίδες άνθρακα, το κύρια αλυσίδα ως η αλυσίδα που έχει τον μεγαλύτερο αριθμό ατόμων άνθρακα και που περιέχει επίσης την ομάδα καρβονυλ. Οι υπόλοιπες αλυσίδες ονομάζονται ως υποκαταστάτες ομάδες.
Επιπλέον, κάθε ομάδα υποκαταστάτη πρέπει να επιλέγεται έτσι ώστε η θέση της να καταλαμβάνει τη χαμηλότερη δυνατή αρίθμηση στην κύρια ανθρακική αλυσίδα. Από την άλλη πλευρά, τα άτομα άνθρακα της κύριας αλυσίδας αρχίζουν να μετρώνται στο άκρο που περιέχει την ομάδα καρβονυλίου. Μερικά παραδείγματα είναι:
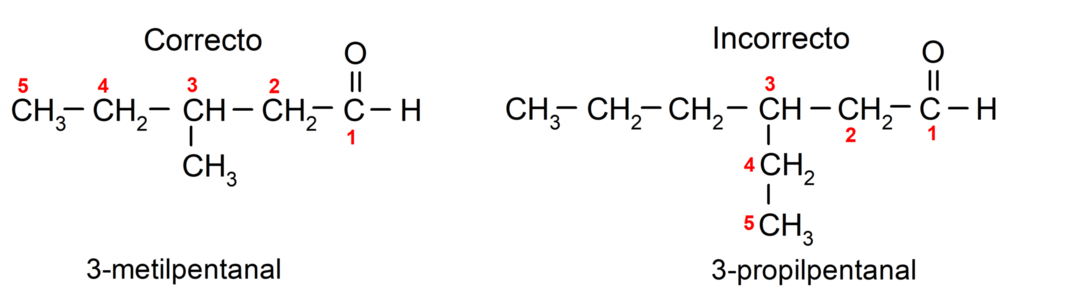
Εάν η αλδεΰδη δρα ως υποκαταστάτης στο μόριο, επειδή αποτελείται επίσης από ομάδες λειτουργικές ομάδες υψηλότερης προτεραιότητας, όπως οξέα και εστέρες, τότε η ομάδα αλδεΰδης ονομάζεται ως -όξο. Για παράδειγμα:

Εάν μια αλδεΰδη έχει πολλές καρβονυλ ομάδες, ονομάζεται χρησιμοποιώντας προθέματα που υποδεικνύουν τον αριθμό αυτών των ομάδων, dial (δύο καρβονυλικές ομάδες), δοκιμαστική (τρεις καρβονυλ ομάδες) κ.λπ. Για παράδειγμα:
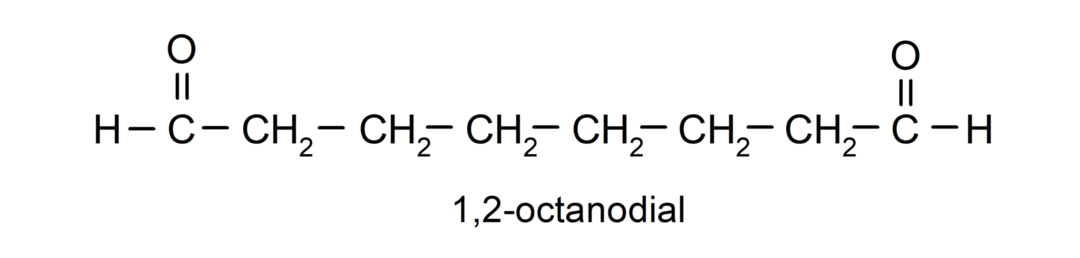
Όταν η καρβονυλική ομάδα συνδέεται με έναν κύκλο, οι αλδεΰδες ονομάζονται χρησιμοποιώντας τον όρο καρβαλδεΰδη. Για παράδειγμα:

Φυσικές ιδιότητες των αλδεΰδων
Οι αλδεΰδες έχουν συνήθως κάποια παραλλαγή της ίδιας φυσικής ιδιότητας. Αυτό συμβαίνει επειδή οι φυσικές ιδιότητες των αλδεΰδων εξαρτώνται από το πώς σχηματίζεται η ανθρακική αλυσίδα που συνδέεται με την καρβονυλ ομάδα.
Μερικές φυσικές ιδιότητες των αλδεΰδων είναι:
- Διαλυτότητα. Η υδατοδιαλυτότητα των αλδεΰδων εξαρτάται από την ποσότητα άτομα που έχει την αλυσίδα άνθρακα. Οι αλδεΰδες με μικρότερες αλυσίδες άνθρακα (μέχρι πέντε περίπου άτομα άνθρακα) είναι διαλυτές στο νερό. Οι αλδεΰδες με αλυσίδες άνθρακα πολλών ατόμων άνθρακα δεν είναι διαλυτές στο νερό. Η μεθανάλη και η αιθανάλη είναι πολύ διαλυτά στο νερό.
- Πυκνότητα. Γενικά, οι αλδεΰδες είναι ενώσεις που είναι λιγότερο πυκνές από το νερό.
- Κράτη συγκέντρωσης. Οι αλδεΰδες που αποτελούνται από ένα και δύο άτομα άνθρακα είναι αέρια, αυτά που περιέχουν μεταξύ τριών και δώδεκα ατόμων άνθρακα είναι υγρά, και αυτά που αποτελούνται από περισσότερα από δώδεκα άτομα άνθρακα είναι στερεά.
- Μυρωδιά. Ορισμένες αλδεΰδες έχουν ερεθιστικές οσμές, ενώ άλλες έχουν ευχάριστες οσμές.
- Πόλωση. Η καρβονυλική ομάδα τους δίνει πολικότητα.
- Σημείο βρασμού. Έχουν υψηλότερα σημεία βρασμού από τα αλκάνια παρόμοιου μοριακού βάρους και έχουν χαμηλότερα σημεία βρασμού από τα καρβοξυλικά οξέα και τις αλκοόλες συγκρίσιμου μοριακού βάρους.
Χημικές ιδιότητες των αλδεΰδων
Μερικές από τις χημικές ιδιότητες των αλδεΰδων είναι:
Οι αλδεΰδες οξειδώνονται όταν αντιδρούν με αντιδραστήρια Tollens, Benedict και Fehling. για να σχηματιστεί το αντίστοιχο καρβοξυλικό οξύ. Το οξύ που σχηματίζεται θα έχει τον ίδιο αριθμό ανθράκων στην ανθρακική αλυσίδα με την αλδεΰδη από την οποία σχηματίστηκε. Για παράδειγμα:
- Οξείδωση με αντιδραστήριο Tollens (σύμπλοκο αμμωνιακού αργύρου σε βασικό διάλυμα, [Ag (NH3)2]+). Αυτή η αντίδραση παράγει το αντίστοιχο οξύ και μεταλλικό άργυρο.

- Οξείδωση με αντιδραστήριο Benedict και Fehling (αλκαλικά διαλύματα θειικού χαλκού (II) (CuSO)4) με διαφορετικές συνθέσεις). Αυτή η αντίδραση παράγει το αντίστοιχο οξύ και οξείδιο του χαλκού (Cu2ΕΙΤΕ).

Υποβάλλονται σε πυρηνόφιλες αντιδράσεις προσθήκης, όπου πυρηνόφιλα προστίθενται στην καρβονυλική ομάδα των αλδεΰδων. Μερικά παραδείγματα είναι:
- αντιδράσεις προσθήκης αλκοόλες στην καρβονυλική ομάδα των αλδεΰδων για να σχηματιστούν ακετάλες και ημιακετάλες.
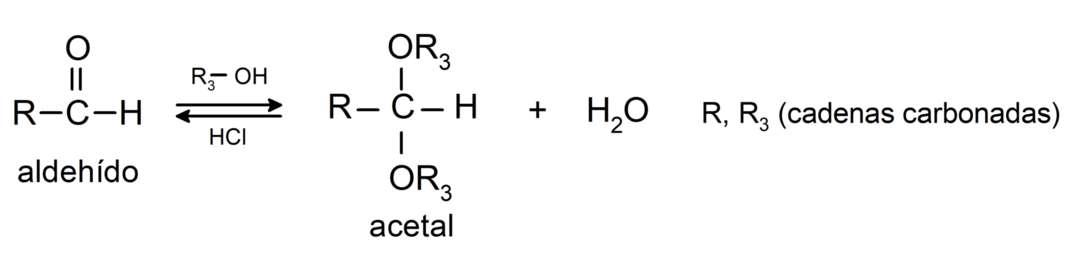
- αντιδράσεις προσθήκης αμίνες πρωτογενές στην ομάδα καρβονυλίου.

- Αντιδράσεις προσθήκης υδροκυανικού οξέος (HCN), όπου σχηματίζονται κυανυδρίνες ή κυανυδρίνες.

Υποβάλλονται σε αντιδράσεις συμπύκνωσης αλδόλης. Σε αυτόν τον τύπο αντίδρασης, δύο αλδεΰδες συμπυκνώνονται για να σχηματίσουν μια αλδόλη. Είναι αντιδράσεις που συμβαίνουν με το υδροξείδιο του νατρίου (NaOH). Για παράδειγμα:
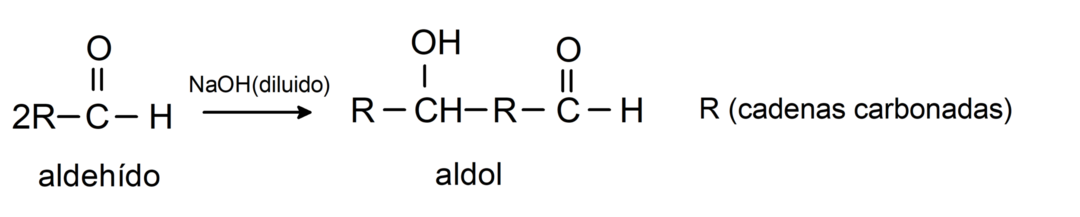
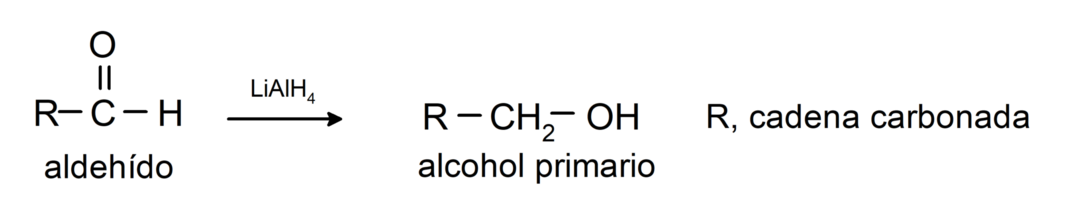
Υποβάλλονται σε αντιδράσεις αναγωγής σε πρωτογενείς αλκοόλες. Παρουσία βοροϋδριδίου του νατρίου (NaBH4) και υδριδίου λιθίου αργιλίου (LiAlH4) ή με καταλυτική υδρογόνωση, ανάγεται σε πρωτοταγείς αλκοόλες. Για παράδειγμα:
Παραδείγματα αλδεΰδων
- μεθανάλη (φορμαλδεΰδη)
- αιθανάλη (ακεταλδεΰδη)
- προπανάλη (προπαλδεΰδη)
- βουτανάλη
- πεντάλ
- βανιλλίνη
- κινναμαλδεΰδη
- προπεναλική
- βενζαλδεΰδη
- εξανάλη
- 3-βρωμοκυκλοπεντανοκαρβαλδεΰδη
- κυκλοεξανοκαρβαλδεΰδη
- 4,4-διμεθυλοπεντανάλη
- 2-υδροξυ-βουτανάλη
- 2-υδροξυ-2-μεθυλ-βουτανάλη
- 2,3-διμεθυλοπεντανάλη
- πεντάδικο
- κυκλοπεντανοκαρβαλδεΰδη
- ισοβουτανική
- 2-χλωρο-βουτανάλη

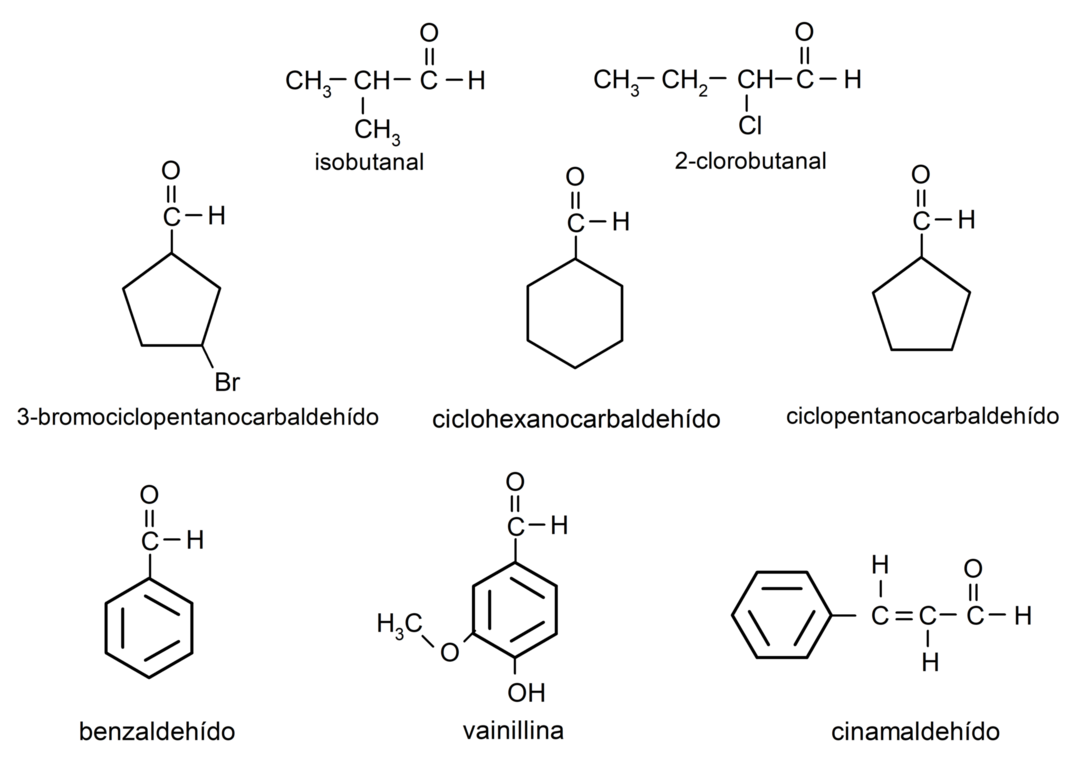
Αλδεΰδες στη φύση
Μερικές αλδεΰδες που υπάρχουν στη φύση είναι:
- Βενζαλδεΰδη, συστατικό των αμυγδάλων.
- Η κινναμαλδεΰδη, το συστατικό που δίνει στην ουσία της κανέλας τη μυρωδιά της.
- Βανιλίνη, το συστατικό που δίνει στη βανίλια τη γεύση της.
Από την άλλη πλευρά, μια από τις μορφές γλυκόζης, η ανοιχτή μορφή, έχει μια λειτουργική ομάδα αλδεΰδης.
Η ακεταλδεΰδη, η οποία σχηματίζεται ως ενδιάμεσο στο μεταβολισμό του αλκοόλ, πιστεύεται ότι προκαλεί συμπτώματα hangover όταν μέθη από αλκοόλ.
Χρήσεις αλδεΰδων
Μερικές από τις κύριες χρήσεις των αλδεΰδων είναι:
- Χρησιμοποιούνται στην παραγωγή διαλυτών, χρωμάτων, καλλυντικών προϊόντων και αιθέριων ουσιών.
- Χρησιμοποιούνται στην κατασκευή ρητινών. Ο βακελίτης είναι κατασκευασμένος με φορμαλδεΰδη και είναι μια ρητίνη που λειτουργεί πολύ καλά ως ηλεκτρικός μονωτήρας.
- Έχουν χρησιμοποιηθεί ως ηρεμιστικά. Η παραλδεΰδη έχει χρησιμοποιηθεί ως καταπραϋντικό και υπνωτικό, αν και πλέον είναι εκτός χρήσης λόγω της δυσάρεστης μυρωδιάς της.
- Χρησιμοποιούνται ως συντηρητικά για βιολογικά δείγματα και πτώματα. Η φορμαλδεΰδη χρησιμοποιείται ευρέως με αυτή την έννοια.
- Χρησιμοποιούνται ως αρώματα τροφίμων. Ένα παράδειγμα είναι η βανιλίνη, η οποία χρησιμοποιείται για να δώσει στα επιδόρπια ένα άρωμα βανίλιας.
- Χρησιμοποιούνται ως απολυμαντικά μέσα.
Κίνδυνοι από αλδεΰδες
Αρκετές αλδεΰδες έχουν θεωρηθεί καρκινογόνες, για παράδειγμα, η φορμαλδεΰδη έχει κηρυχθεί καρκινογόνος ένωση σύμφωνα με τον ΠΟΥ (Παγκόσμια Οργάνωση Υγείας).
Η έκθεση και η επαφή με πολλές αλδεΰδες προκαλεί ερεθισμό στο δέρμα, τα μάτια και την αναπνευστική οδό. Από την άλλη, προκαλεί δερματίτιδα εξ επαφής και ηπατικές παθήσεις.
βιβλιογραφικές αναφορές
- Solomons, T.W. Graham και María Cristina Sangines Franchini (1985). “οργανική χημείαΜεξικό, D.F.: Limusa.
- Γουίτεν, Κ. W., Gailey, Κ. D., Davis, R. E., de Sandoval, M. Τ. ΠΡΟΣ ΤΗΝ. O., & Muradás, R. Μ. σολ. (1992). “Γενική Χημεία" (σελ. 108-117). McGraw-Hill.
- Αρτέαγα, Π. Μ. (2017). “Κετόνες και αλδεΰδες” Επιστημονικό Δελτίο Con-Science του Προπαρασκευαστικού Σχολείου Αρ. 3, 4(8).
Ακολουθήστε με:
- σάκχαρα
- Υδροξέα
- Εθυλική αλκοόλη
- Οργανικές και ανόργανες ενώσεις
