30 Παραδείγματα Αλκοόλ
Παραδείγματα / / November 06, 2023
ο αλκοόλες είναι οργανικές χημικές ενώσεις που περιέχουν στη δομή τους την υδροξυλική λειτουργική ομάδα (-ΟΗ) συνδεδεμένη με έναν άνθρακα (-C). Η ομάδα (- C – OH) ονομάζεται «καρβινόλη». Μερικά παραδείγματα αλκοολών είναι: μεθανόλη, αιθανόλη και 1-προπανόλη.
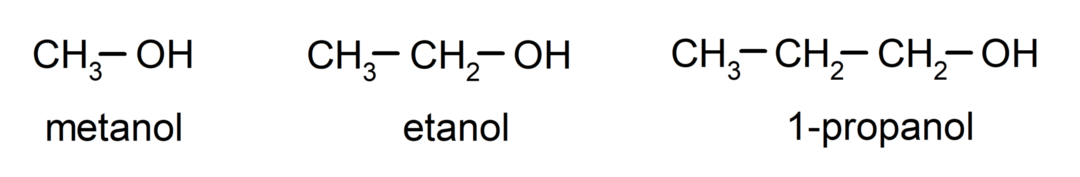
Οι αλκοόλες είναι χημικές ενώσεις με ποικίλες χρήσεις στην καθημερινή ζωή, καθώς έχουν αντιβακτηριδιακές και αντισηπτικές ιδιότητες. Από την άλλη πλευρά, μπορεί να είναι επικίνδυνα για την ανθρώπινη υγεία όταν καταποθούν ανεξέλεγκτα.
Ομοίως, δεν μπορούν να καταποθούν όλες οι αλκοόλες από τον άνθρωπο.
- Δείτε επίσης: Αμίνες και κετόνες
Τύποι αλκοολών
Ανάλογα με τον αριθμό των ατόμων άνθρακα στα οποία είναι συνδεδεμένο το άτομο άνθρακα που έχει συνδεδεμένη την υδροξυλική ομάδα, μια αλκοόλη μπορεί να είναι:
- Πρωτοταγής αλκοόλη. Το άτομο άνθρακα που έχει συνδεδεμένη την ομάδα υδροξυλίου συνδέεται επίσης με ένα μόνο άτομο άνθρακα. Για παράδειγμα:
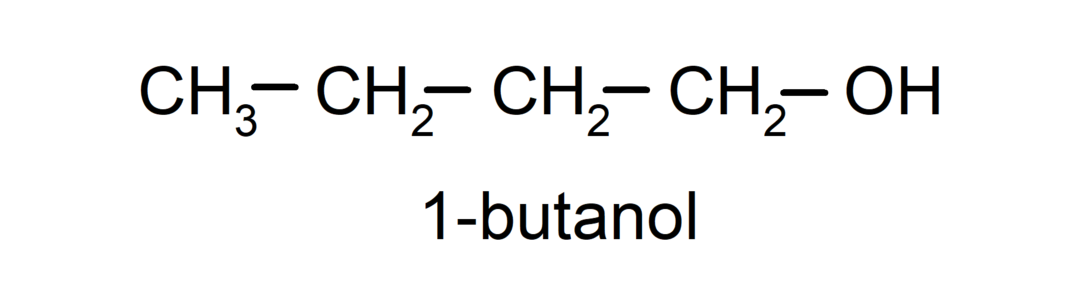
- Δευτερογενές αλκοόλ. Το άτομο άνθρακα που έχει συνδεδεμένη την ομάδα υδροξυλίου συνδέεται επίσης με δύο άλλα άτομα άνθρακα. Για παράδειγμα:
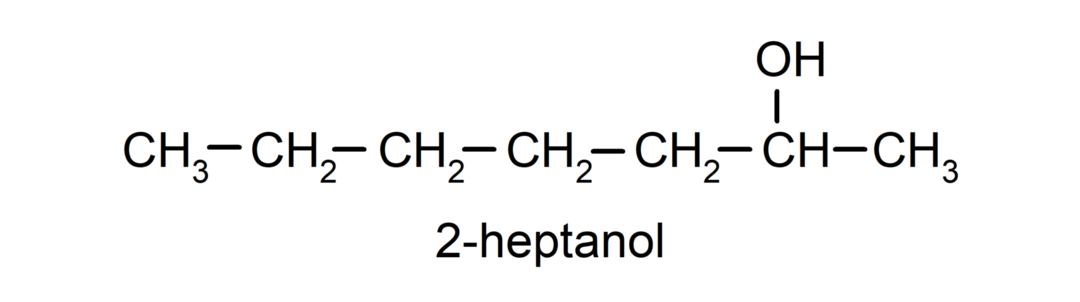
- Τριτογενές αλκοόλ. Το άτομο άνθρακα που έχει συνδεδεμένη την ομάδα υδροξυλίου συνδέεται επίσης με τρία άτομα άνθρακα. Για παράδειγμα:
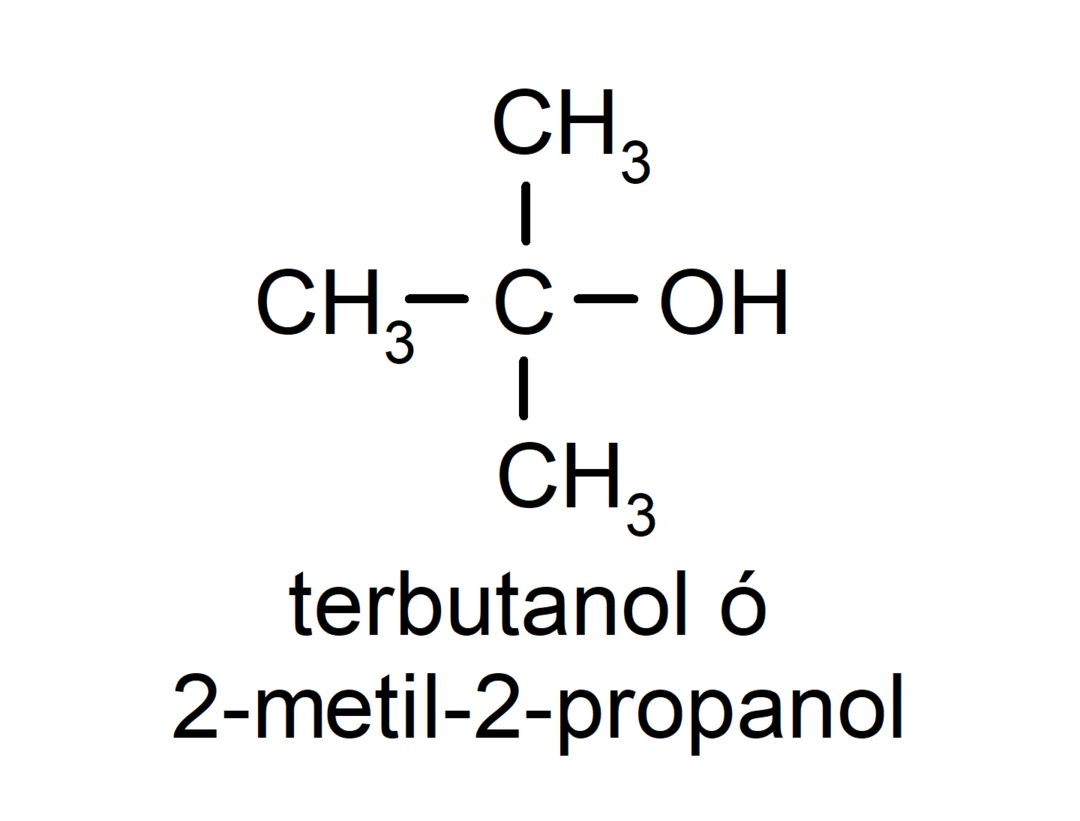
Ανάλογα με τον αριθμό των υδροξυλομάδων που έχει, μια αλκοόλη μπορεί να είναι:
- Diol. Έχει δύο ομάδες υδροξυλίου στη δομή του. Για παράδειγμα:
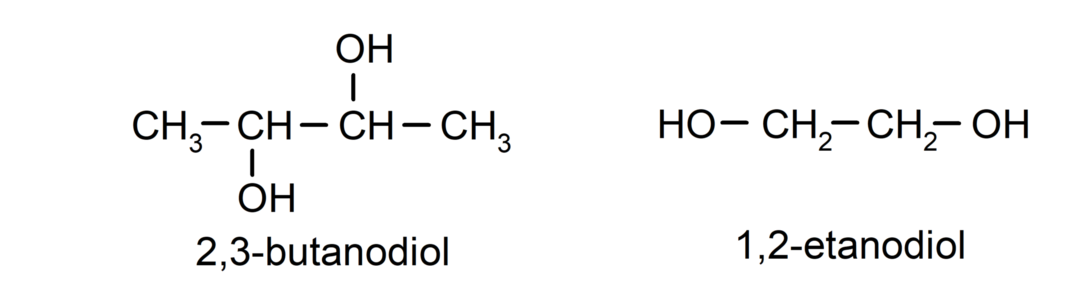
- Triol. Έχει τρεις ομάδες υδροξυλίου στη δομή του. Για παράδειγμα:
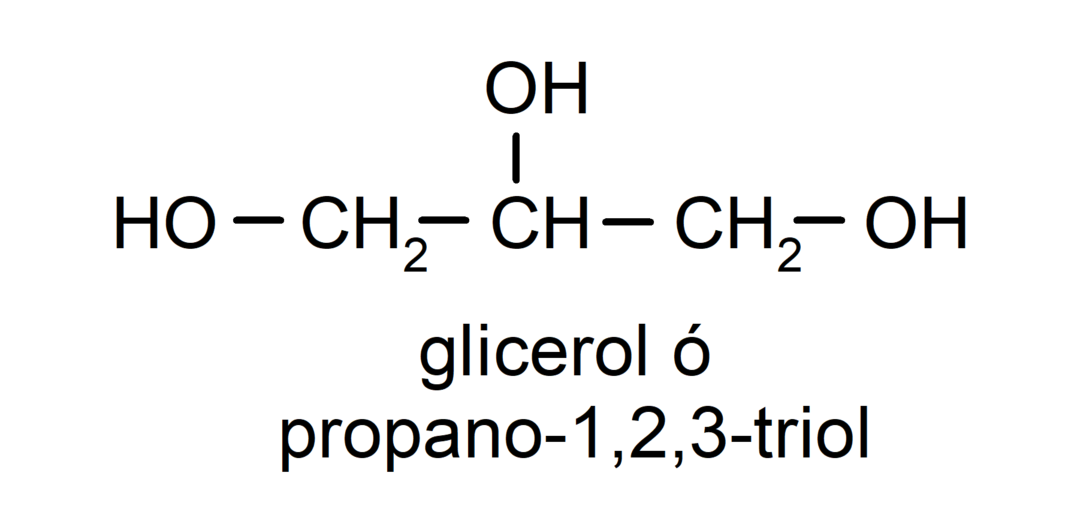
- Πολυαλκοόλη. Έχει πολλές υδροξυλομάδες στη δομή του. Για παράδειγμα:
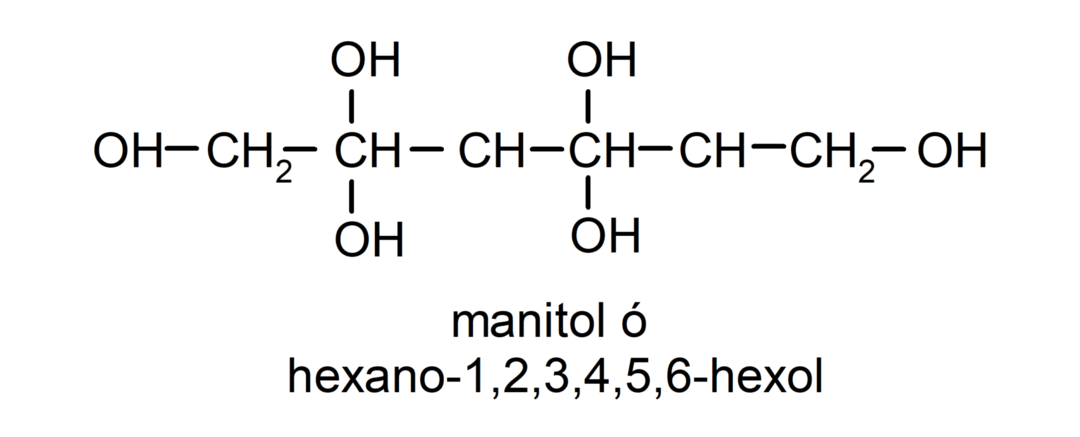
Φυσικές ιδιότητες των αλκοολών
Μερικές από τις φυσικές ιδιότητες των αλκοολών είναι:
- Σημείο βρασμού. Το σημείο βρασμού στις αλκοόλες είναι αρκετά υψηλό λόγω της παρουσίας της ομάδας υδροξυλίου, η οποία επιτρέπει το σχηματισμό δεσμών υδρογόνου. Επιπλέον, όσο περισσότερες λειτουργικές ομάδες υδροξυλίου υπάρχουν στην ανθρακική αλυσίδα, τόσο υψηλότερο είναι Σημείο βρασμού των αλκοολών.
- Πόλωση. Οι αλκοόλες είναι αρκετά πολικές ενώσεις.
- Διαλυτότητα. Οι αλκοόλες χαμηλού μοριακού βάρους είναι διαλυτές στο νερό. Από την άλλη, όσο μεγαλύτερη είναι η ανθρακική αλυσίδα των αλκοολών, τόσο μικρότερη είναι η διαλυτότητά τους στο νερό. Επιπλέον, όσο περισσότερες υδροξυλομάδες έχουν οι αλκοόλες, τόσο μεγαλύτερη είναι η διαλυτότητά τους στο νερό.
- Κατάσταση συγκέντρωσης. Οι περισσότερες αλκοόλες είναι υγρές σε θερμοκρασία δωματίου (25ºC) και έχουν χαρακτηριστικές οσμές.
Χημικές ιδιότητες των αλκοολών
Μερικές από τις χημικές ιδιότητες των αλκοολών είναι:
- Οι αλκοόλες συμπεριφέρονται σαν οξέα και βάσεις.. Η συμπεριφορά τους ως οξέα μπορεί να φανεί σε αντιδράσεις με ενεργά μέταλλα για την απελευθέρωση αερίου υδρογόνου και το σχηματισμό αλκοξειδίων.

Η συμπεριφορά τους ως βάσεις μπορεί να φανεί σε αντιδράσεις όπως η αντίδραση της μεθανόλης με το υδροβρώμιο για να σχηματιστεί βρωμιούχο μεθυλοξόνιο.
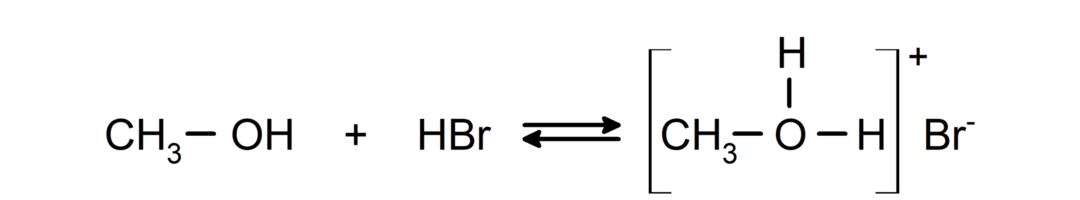
- Οι αλκοόλες υφίστανται αντιδράσεις αλογόνωσης. Αντιδρούν με υδραλογονίδια για να σχηματίσουν αλκυλαλογονίδια.
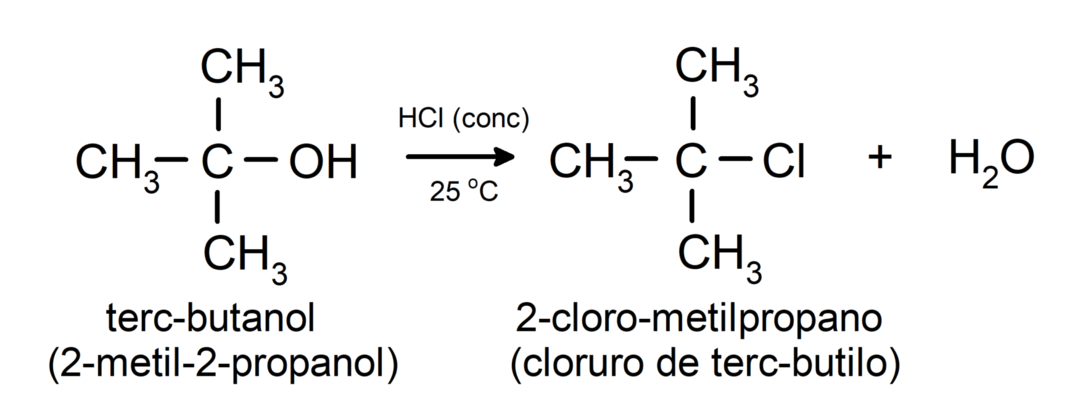
-
Οι αλκοόλες υφίστανται αντιδράσεις οξείδωσης όταν αντιδρούν με ορισμένες οξειδωτικές ενώσεις. Τα προϊόντα των αντιδράσεων οξείδωσης εξαρτώνται από τον τύπο της αλκοόλης που αντιδρά, δηλαδή αν είναι πρωτοταγής, δευτεροταγής ή τριτοταγής.
Οξείδωση πρωτοταγούς αλκοόλης για σχηματισμό αλδεΰδης ή καρβοξυλικού οξέος.
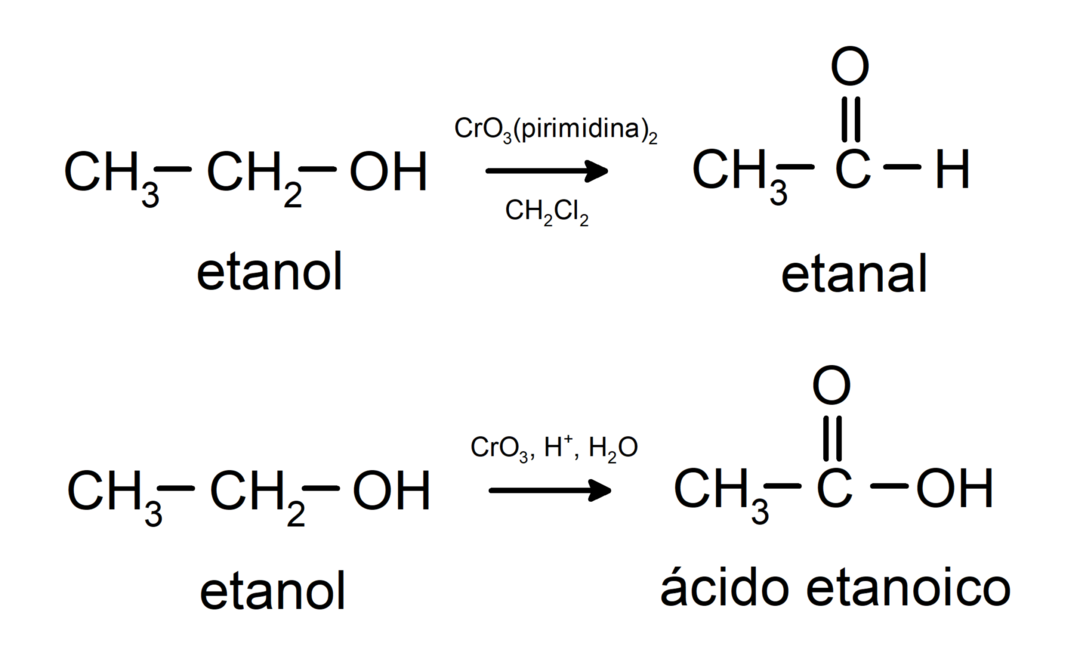
Οξείδωση δευτεροταγούς αλκοόλης για σχηματισμό κετόνης.
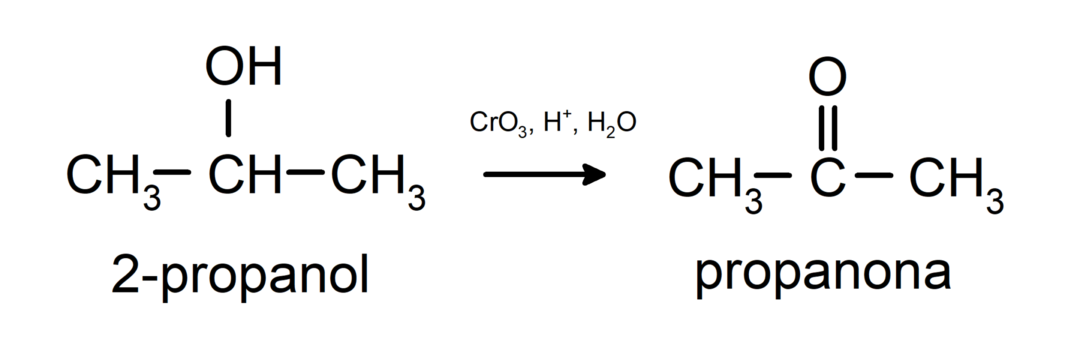
Οι τριτοταγείς αλκοόλες δεν οξειδώνονται με κοινά οξειδωτικά. Με πολύ ισχυρά οξειδωτικά μέσα μπορούν να μετατραπούν σε αλκένια, τα οποία στη συνέχεια μπορούν να οξειδωθούν.
Οι αλκοόλες που έχουν δύο ομάδες υδροξυλίου που βρίσκονται σε παρακείμενους άνθρακες οξειδώνονται με τετραοξικό μόλυβδο για να σχηματιστούν δύο κετόνες.
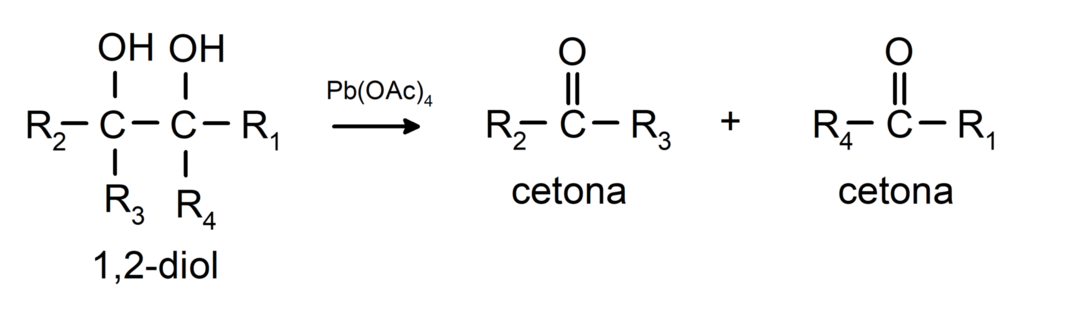
- Οι αλκοόλες υφίστανται αντιδράσεις αφυδρογόνωσης. Αυτές οι αντιδράσεις συμβαίνουν μόνο με πρωτοταγείς και δευτεροταγείς αλκοόλες, οι οποίες όταν υποβάλλονται σε υψηλές θερμοκρασίες παρουσία καταλυτών, απελευθερώνουν υδρογόνα.
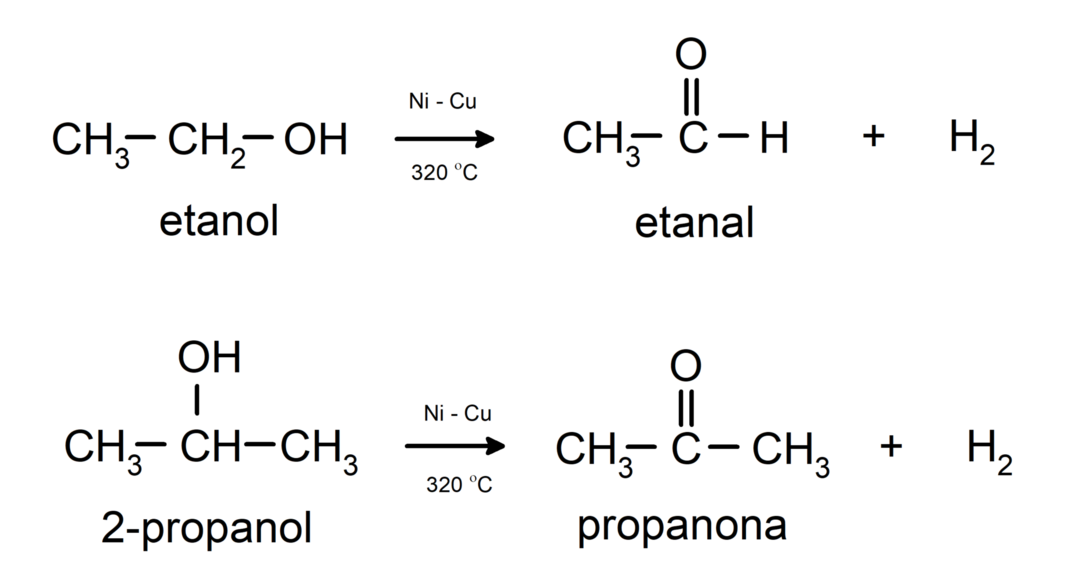
- Τα αλκοόλ υφίστανται αντιδράσεις αφυδάτωσης. Οι αλκοόλες αφυδατώνονται για να σχηματίσουν τα αντίστοιχα αλκένια. Αυτή η αντίδραση λαμβάνει χώρα παρουσία οξέος και ενδιάμεσων θερμοκρασιών.
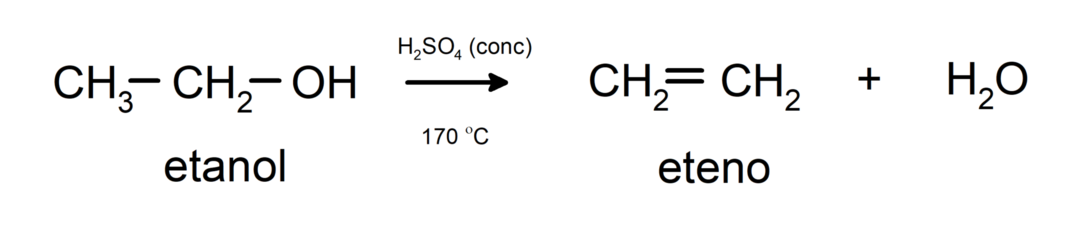
Ονοματολογία αλκοόλ
Σύμφωνα με την ονοματολογία που καθιερώθηκε από την IUPAC (Διεθνής Ένωση Καθαρής και Εφαρμοσμένης Χημείας), οι αλκοόλες ονομάζονται σύμφωνα με τους ακόλουθους κανόνες:
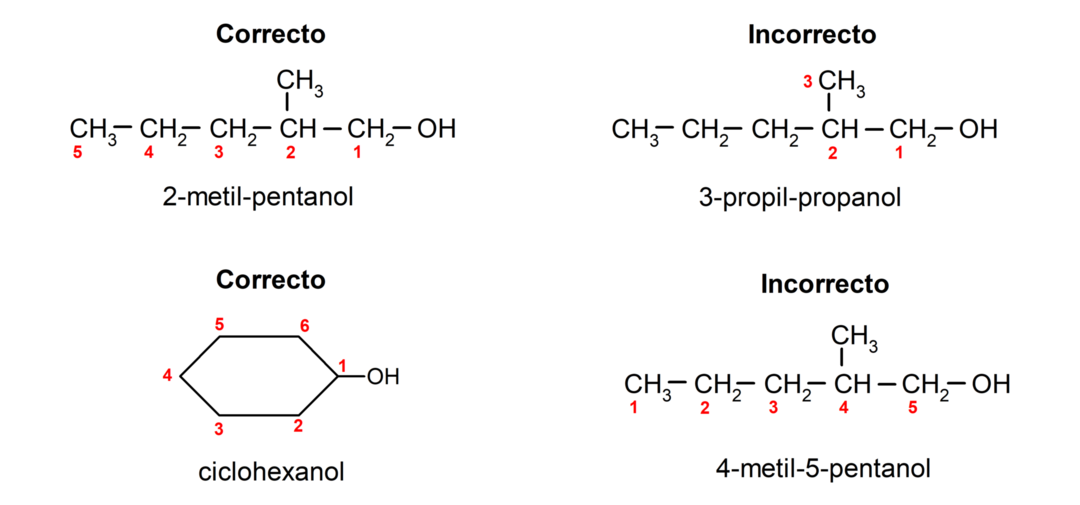
- Η θέση της ομάδας υδροξυλίου επιλέγεται λαμβάνοντας υπόψη ότι καταλαμβάνει τον μικρότερο δυνατό αριθμό στην ανθρακική αλυσίδα. Εάν η δομή της αλκοόλης είναι κυκλική, λαμβάνεται υπόψη η 1 θέση στον άνθρακα που έχει συνδεδεμένη την υδροξυλική ομάδα και χρησιμοποιείται το πρόθεμα κυκλο- για την ονομασία της.
- Το όνομα της αλκοόλης γράφεται χρησιμοποιώντας προθέματα που υποδεικνύουν τον αριθμό των ατόμων στην ανθρακική αλυσίδα και επιπλέον τοποθετείται το επίθημα -ol.
- Εάν η δομή της αλκοόλης έχει κλάδους, η μακρύτερη αλυσίδα που περιέχει επίσης την ομάδα υδροξυλίου επιλέγεται ως κύρια ανθρακική αλυσίδα.
Σύμφωνα με την Παραδοσιακή ονοματολογία, οι αλκοόλες ονομάζονται γράφοντας τη λέξη «οινόπνευμα» και στη συνέχεια γράφοντας το όνομα του αλκοόλ. αλκάνιο που αντιστοιχεί στην ανθρακική αλυσίδα, αλλά αντί να χρησιμοποιηθεί η κατάληξη -ane του αλκανίου, η κατάληξη -υλικό.
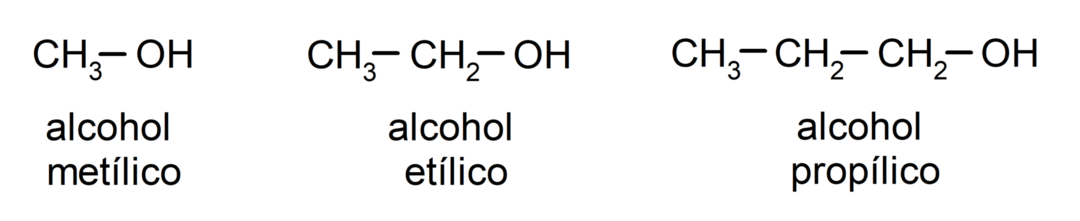
Παραδείγματα αλκοολών
- μεθανόλη
- αιθανόλη
- 1-προπανόλη
- 2-προπανόλη
- 1-βουτανόλη
- 3-αιθυλεξαν-2-όλη
- γλυκερίνη
- φαινόλη
- 2-μεθυλ-2-βουτανόλη
- 1,2-αιθανοδιόλη
- 1,5-επταδιεν-3-όλη
- 3-μεθυλ-2-βουτανόλη
- βενζυλομεθανόλη
- 3-πεντανόλη
- 2-μεθυλφαινόλη
- 1,2-διυδροξυφαινόλη
- cycloheaxnol
- 1-φαινυλαιθανόλη


Χρήσεις αλκοολών
Οι πιο κοινές χρήσεις των αλκοολών είναι:
- Χρησιμοποιούνται ως απολυμαντικά και αντισηπτικά αφού σταματούν την ανάπτυξη ορισμένων μικροοργανισμών ή να τα καταστρέψουν. Η αιθανόλη και η ισοπροπυλική αλκοόλη είναι οι πιο χρησιμοποιούμενες για το σκοπό αυτό.
- Χρησιμοποιούνται στη σύνθεση διαφορετικών χημικές ενώσεις. Η μεθανόλη, για παράδειγμα, χρησιμοποιείται για τη λήψη μεθανάλης (φορμαλδεΰδης).
- Χρησιμοποιούνται για την παραγωγή αντιψυκτικού. Η μεθανόλη είναι από τις πιο χρησιμοποιούμενες για το σκοπό αυτό.
- Χρησιμοποιούνται ως διαλύτες στη φαρμακοβιομηχανία. Η αιθανόλη είναι μια από τις πιο χρησιμοποιούμενες με αυτή την έννοια.
- Χρησιμοποιούνται ως διαλύτες για λάκες, βαφές και μελάνια. Η μεθανόλη χρησιμοποιείται ευρέως για το σκοπό αυτό.
- Χρησιμοποιούνται ως καύσιμο και υπάρχει μια σημαντική τάση μερικής αντικατάστασης της χρήσης ορυκτά καύσιμα με τη χρήση καυσίμου βιοαιθανόλης.
- Χρησιμοποιούνται για την κατασκευή ρητινών. Η φαινόλη χρησιμοποιείται με αυτή την έννοια.
Κίνδυνοι από την κατανάλωση αλκοόλ
Αν και η κατανάλωση αλκοόλ είναι κοινωνικά αποδεκτή σήμερα, η κατάχρηση αυτής της ουσίας προκαλεί εξάρτηση και εθισμό.
Η αιθανόλη είναι η αλκοόλη που υπάρχει στα αλκοολούχα ποτά, η οποία όταν καταναλώνεται σε υπερβολική ποσότητα επηρεάζει γνωστικές ικανότητες και μπορεί να προκαλέσει καρδιαγγειακή νόσο, κίρρωση του ήπατος και Καρκίνος.
Επιπλέον, όταν επιτευχθεί ο βαθμός μέθης, δηλαδή σε κατάσταση μέθης, εάν η δόση του το αλκοόλ είναι πολύ υψηλό, μπορεί να εμφανιστεί αλκοολικό κώμα, το οποίο μπορεί να οδηγήσει σε αναπνευστική παράλυση και ακόμη και θάνατο. θάνατος.
βιβλιογραφικές αναφορές
- Τ. ΠΡΟΣ ΤΗΝ. Geissman. (1974) “Principles of Organic Chemistry” Δεύτερη Έκδοση. Editorial Reverté, S.A. ISBN: 8429171800
- Ahumada-Cortez, J. G., Gámez-Medina, M. E., & Valdez-Montero, C. (2017). Η κατανάλωση αλκοόλ ως πρόβλημα δημόσιας υγείας. Ρα Ξιμχάι, 13(2), 13-24.
- Μόρισον, Ρ. T., & Boyd, R. Ν. (1998). Οργανική χημεία. Εκπαίδευση Pearson.
- Weininger, S. J., & Stermitz, F. R. (1988). Οργανική χημεία. αντέστρεψα.
Ακολουθήστε με:
- Εθυλική αλκοόλη
- Καύσιμα
- οργανική χημεία
