30 Παραδείγματα δυαδικών πωλήσεων
Παραδείγματα / / November 09, 2023
ο δυαδικά άλατα (ουδέτερα άλατα) σχηματίζονται όταν ένα μέταλλο και ένα αμέταλλο συνδυάζονται. Είναι χημικές ενώσεις αποτελείται μόνο από δύο χημικά στοιχεία. Για παράδειγμα: χλωριούχο νάτριο (NaCl) και βρωμιούχο κάλιο (KBr).
- Δείτε επίσης: Μέταλλα και αμέταλλα
Παραδείγματα δυαδικών αλάτων
- Χλωριούχο νάτριο (NaCl)
- Χλωριούχος σίδηρος (II) (FeCl2)
- Χλωριούχος σίδηρος (III) (FeCl3)
- Θειούχο κοβάλτιο (II) (CoS)
- Θειούχο κοβάλτιο (III) (Co2Ναί3)
- Θειούχο μόλυβδο (II) (PbS)
- Θειούχο μόλυβδο (IV) (PbS2)
- Χλωριούχο ασβέστιο (CaCl2)
- Φθοριούχο νάτριο (NaF)
- Χλωριούχο λίθιο (LiCl)
- Χλωριούχο στρόντιο (SrCl2)
- Χλωριούχο βάριο (BaCl2)
- Χλωριούχο αργίλιο (AlCl3)
- Θειούχο μαγνήσιο (MgS)
- Χλωριούχο ρουβίδιο (RbCl)
- Βρωμιούχο ασβέστιο (CaBr2)
- Θειούχο κάλιο (Κ2ΜΙΚΡΟ)
- Βρωμιούχο μαγνήσιο (MgBr2)
- Θειούχος ψευδάργυρος (Zn2ΜΙΚΡΟ)
- Βρωμιούχο λίθιο (LiBr)
- Χλωριούχο νικέλιο (NiCl2)
- Χλωριούχο ουράνιο (III) (UCl3)
- Βρωμιούχος άργυρος (AgBr)
- Ιωδιούχος άργυρος (AgI)
- Βρωμιούχο κάλιο (KBr)
Ονοματολογία δυαδικών αλάτων
Σύμφωνα με την Παραδοσιακή Ονοματολογία, τα δυαδικά άλατα ονομάζονται γράφοντας το όνομα του μη μεταλλικού στοιχείου με την κατάληξη -ide. Από την άλλη πλευρά, το όνομα του μεταλλικού στοιχείου γράφεται σύμφωνα με την κατάσταση οξείδωσής του:
- Για τη χαμηλότερη κατάσταση οξείδωσης, γράφεται με την κατάληξη -oso. Για παράδειγμα: χλωριούχος σίδηρος (FeCl2), όπου ο σίδηρος έχει κατάσταση οξείδωσης 2+.
- Για την υψηλότερη κατάσταση οξείδωσης, γράφεται με την κατάληξη -ico. Για παράδειγμα: χλωριούχος σίδηρος (FeCl3), όπου ο σίδηρος έχει κατάσταση οξείδωσης 3+.
Σύμφωνα με τη Συστηματική Ονοματολογία, τα δυαδικά άλατα ονομάζονται γράφοντας το όνομα του μη μεταλλικού στοιχείου με ένα πρόθεμα που υποδεικνύει την ποσότητα του άτομα αυτού του στοιχείου στην ένωση. Επιπλέον, η κατάληξη -uro τοποθετείται στο όνομα του μη μεταλλικού στοιχείου. Στη συνέχεια, τοποθετείται το όνομα του μεταλλικού στοιχείου. Για παράδειγμα: διχλωριούχο μαγνήσιο (MgCl2) και τριχλωριούχου σιδήρου (FeCl3).
Σύμφωνα με την ονοματολογία του Stock, τα δυαδικά άλατα ονομάζονται γράφοντας το όνομα του μη μεταλλικού στοιχείου με την κατάληξη -ide. Στη συνέχεια, τοποθετείται το όνομα του μεταλλικού στοιχείου ακολουθούμενο από την κατάσταση οξείδωσής του γραμμένο με λατινικούς αριθμούς και σε παρένθεση. Για παράδειγμα: χλωριούχος σίδηρος (II) (FeCl2) και σουλφίδιο κοβαλτίου (III) (Co2Ναί3).
Εφαρμογές δυαδικών αλάτων
- Χρησιμοποιούνται ως ψυκτικά μέσα στις βιομηχανίες τροφίμων και φαρμακευτικών προϊόντων. Για παράδειγμα: χλωριούχο ασβέστιο (CaCl2).
- Χρησιμοποιούνται για την επεξεργασία μεταλλικών επιφανειών κατά της διάβρωσης. Για παράδειγμα: φθοριούχο νάτριο (NaF).
- Χρησιμοποιούνται για τη ρύθμιση της υγρασίας στη βιομηχανία χαρτιού και κατασκευών. Για παράδειγμα: χλωριούχο ασβέστιο (CaCl2).
- Χρησιμοποιούνται στη βιομηχανία γυαλιού για την εξάλειψη των ακαθαρσιών. Για παράδειγμα: τετραχλωριούχο πυρίτιο (SiCl4).
- Χρησιμοποιούνται ως υλικά μαγειρικής. Για παράδειγμα: χλωριούχο νάτριο (NaCl).
Φυσικές ιδιότητες δυαδικών αλάτων
- Έχουν υψηλά σημεία τήξης γιατί αποτελούνται από ιοντικούς δεσμούς.
- Διοχετεύουν ηλεκτρικό ρεύμα όταν διαλύονται ή λιώνουν.
- Τα πιο κοινά άλατα έχουν χαμηλή σκληρότητα.
- Δεν είναι συμπιεστά.
- Τα περισσότερα μπορούν να διαλυθούν στο νερό.
Πώς λαμβάνονται τα δυαδικά άλατα;
Τα δυαδικά άλατα μπορούν να ληφθούν μέσω ορισμένων από τις ακόλουθες χημικές αντιδράσεις:
Αντίδραση μεταξύ ενός μετάλλου και ενός αμέταλλου. Για παράδειγμα: η αντίδραση μεταξύ νατρίου (Na) και διχλωριούχου (Cl2) παράγει χλωριούχο νάτριο (NaCl).
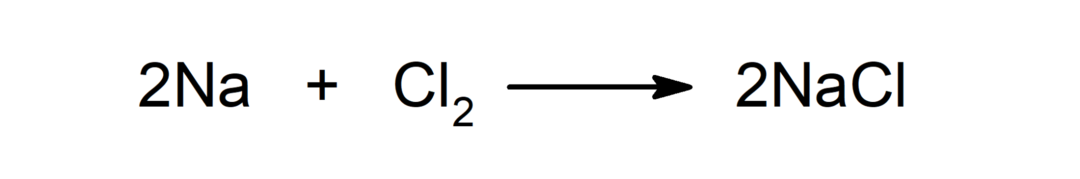
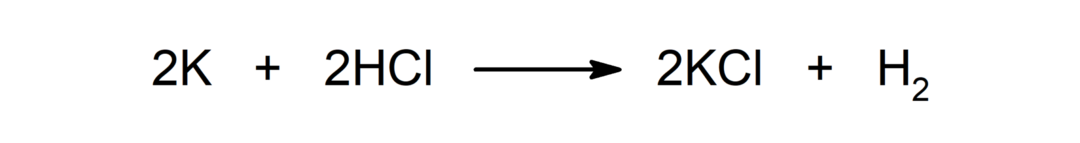
Αντίδραση μεταξύ ενός μετάλλου και ενός οξέος. Για παράδειγμα: Η αντίδραση μεταξύ καλίου (Κ) και υδροχλωρικού οξέος (HCl) παράγει χλωριούχο κάλιο (KCl) και διυδρογόνο (Η2).
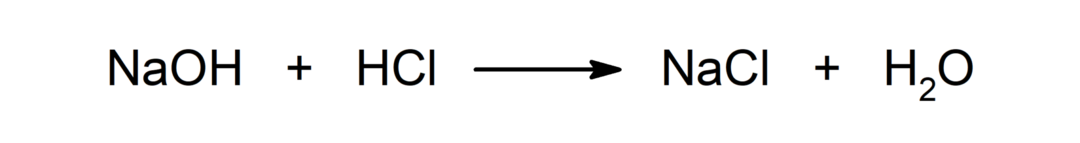
Αντίδραση μεταξύ οξέος και βάσης. Για παράδειγμα: Η αντίδραση μεταξύ υδροχλωρικού οξέος (HCl) και υδροξειδίου του νατρίου (NaOH) παράγει χλωριούχο νάτριο (NaCl) και νερό (H2ΕΙΤΕ).
Ακολουθήστε με:
- οξυάλατα
- ουδέτερα άλατα
- όξινα άλατα
βιβλιογραφικές αναφορές
- Cerón Villalba, A., Novoa Ramírez, C. S., & Alpizar Juárez, E. (2020). Ονοματολογία βίντεο 1: δυαδικά άλατα και χημική αντίδραση.
- Ακούριο Αρίας, Μ. V., & Delgado Méndez, M. ΚΑΙ. (2022). Οδηγός εκμάθησης βασισμένου παιχνιδιού για «δυαδικές ενώσεις» στη Χημεία Λυκείου στην Εκπαιδευτική Μονάδα «Herlinda Toral» (Πτυχιακή εργασία, Εθνικό Πανεπιστήμιο Εκπαίδευσης).
- Καμπρέρα, Μ. J. H. (2005). Μελέτη από τις πρώτες αρχές των ηλεκτρονικών και δομικών ιδιοτήτων δυαδικών και τριμερών ενώσεων (Διδακτορική διατριβή, University of La Laguna).


