Παράδειγμα Χημικών Στοιχείων
Χημεία / / July 04, 2021
Ένα χημικό στοιχείο Είναι μια καθαρή ουσία που αποτελείται από άτομα του ίδιου τύπου, με τη σειρά του σχηματίστηκε από έναν αριθμό πρωτονίων και νετρονίων στον πυρήνα, και μια ποσότητα ηλεκτρόνια στα τροχιακά τους. Μερικά βρίσκονται φυσικά, άλλα σχηματίζοντας τα μόρια μιας ένωσης και άλλα έχουν δημιουργηθεί μέσω της εκτέλεσης εργαστηριακών διαδικασιών. Όλα τα χημικά στοιχεία αποτελούν την ύλη ολόκληρου του σύμπαντος και διατηρούν την ύπαρξη και τη λειτουργία του ανθρώπινου σώματος.
Κάθε στοιχείο έχει χαρακτηριστικά και συμπεριφορές που του δίνουν διάκριση και το κάνουν μοναδικό, αλλά ταυτόχρονα παρουσιάζει ομοιότητες με μια ομάδα στοιχείων στην εκδήλωση που έχουν στο σύμπαν. Για αυτόν τον λόγο, υπάρχει ο Περιοδικός Πίνακας Χημικών Στοιχείων, ο οποίος εξετάζει αυτές τις ομοιότητες για να ομαδοποιεί συνεκτικά τα στοιχεία και να διευκολύνει τη μελέτη των ιδιοτήτων τους.
Ατομικός αριθμός ενός στοιχείου
Το άτομο φέρει στον πυρήνα έναν αριθμό πρωτονίων, που συνοδεύεται από τον ίδιο αριθμό νετρονίων
. Σε αυτόν τον αριθμό ονομάζεται ατομικός αριθμός, εκπροσωπείται ως Ζ για ακαδημαϊκούς σκοπούς και στη Λογοτεχνία. Για κάθε στοιχείο, αυτός ο αριθμός θα είναι μοναδικός. Δεν υπάρχουν δύο στοιχεία με τον ίδιο ατομικό αριθμό. Ο Περιοδικός Πίνακας εστιάζει επίσης σε αυτό το κριτήριο για την παραγγελία τους.Σύμβολο ενός στοιχείου
Στην εποχή της Αλχημείας, η οποία εκτείνεται περίπου το έτος 400 έως 1000 μ.Χ. Γ., Οι Αλχημιστές κατέγραψαν τα πειράματά τους εκχωρώντας σύμβολα στα στοιχεία. Ήταν απλά σύμβολα, φτιαγμένα με γεωμετρικά σχήματα, που αντιπροσωπεύουν το μεμονωμένο στοιχείο και τους μετασχηματισμούς που μελετήθηκαν.
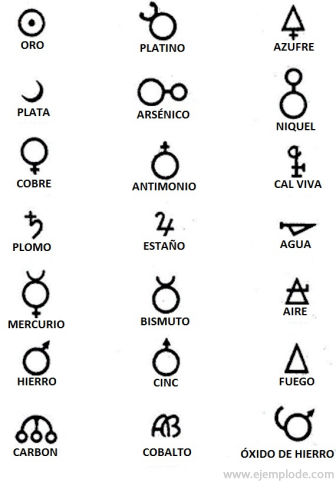
Μερικά παραδείγματα αλχημικών συμβόλων, με το όνομα του στοιχείου ή της ένωσης που αντιπροσώπευαν.
Στην εποχή της σύγχρονης χημείας, τα στοιχεία εξακολουθούν να αντιπροσωπεύονται με σύμβολα, στην περίπτωση αυτή γράμματα που αναφέρονται στο όνομά τους στα λατινικά ή στα αγγλικά.
Για παράδειγμα:
Το σύμβολο για το νάτριο είναι ΝΑ, με το λατινικό της όνομα Νάτριο
Το σύμβολο του χρυσού είναι Ω, με το λατινικό της όνομα Aurum
Το σύμβολο για το Silver είναι Αγ, με το λατινικό της όνομα Αργεντινό
Το σύμβολο για το Copper είναι Κου, με το λατινικό της όνομα Χαλκός
Το σύμβολο του Antimony είναι Sb, με το λατινικό της όνομα Αντιμόνιο
Το σύμβολο του Σιδήρου είναι Πίστη, με το λατινικό της όνομα Σίδηρος
Το σύμβολο του Ερμή είναι Hg, με το λατινικό της όνομα Υδροργύριο, που σημαίνει "υγρό ασήμι"
Το σύμβολο για το κάλιο είναι κ, με το λατινικό της όνομα Κάλιουμ
Ομάδες χημικών στοιχείων:
Ο Περιοδικός Πίνακας Χημικών Στοιχείων τα ταξινομεί ανά ομάδες: ομάδες Α και ομάδες Β. Οι ομάδες Α είναι οκτώ, οι οποίες περιέχουν τα στοιχεία Αλκαλική, ο Αλκαλικός-Γήινος, ο Terreos, τρεις οικογένειες Elements, των οποίων το κεφάλι ορίζει το όνομα της οικογένειας: Οικογένεια άνθρακα, Οικογένεια αζώτου, Οικογένεια θείου, ο Αλογόνα και το ευγενή αέρια. Οι ομάδες Β αποτελούνται από όλα τα Μεταβατικά μέταλλα και οι Σπάνιες Γη, που είναι επίσης δύο μεγάλες οικογένειες: Λανθάνης Γ Ακτινίδες.
Ομάδα IA: Αλκαλικά στοιχεία:
Η σειρά των αλκαλικών στοιχείων αποτελείται από υδρογόνο (Η), λίθιο (Li), νάτριο (Na), κάλιο (K), ρουβίδιο (Rb), καίσιο (Cs) και Francium (Fr). Όλοι έχουν μια ηλεκτρονική διαμόρφωση έτσι ώστε στο τελευταίο κέλυφος να έχουν ένα ηλεκτρόνιο. Το όνομά τους οφείλεται στο γεγονός ότι όταν έρχονται σε επαφή με το νερό, αντιδρούν για να σχηματίσουν Αλκάλη ή Υδροξείδια. Είναι μια γενική συμπεριφορά μεταξύ αυτών των στοιχείων. Όσο μεγαλύτερο είναι το άτομο του στοιχείου, τόσο πιο δραστικό είναι, καθώς η δύναμη με την οποία ο πυρήνας συγκρατεί το ηλεκτρόνιο από το τελευταίο κέλυφος έχει λιγότερη και λιγότερη εμβέλεια. Είναι ικανοί να σχηματίζουν Ιονικά Ομόλογα με Αλογόνα. Για παράδειγμα: Ο ιονικός δεσμός που έχει άφθονη παρουσία είναι αυτός του χλωριούχου νατρίου, σχηματίζοντας χλωριούχο νάτριο NaCl.
Ομάδα IIA: Στοιχεία αλκαλικής γης:
Αυτά τα στοιχεία είναι: Βηρύλλιο (Be), Μαγνήσιο (Mg), Ασβέστιο (Ca), Στρόντιο (Sr), Βαρίου (Ba) και Ράδιο (Ra). Δεν είναι ελεύθεροι στη φύση. από την άλλη πλευρά, τα ανθρακικά και πυριτικά άλατά του υπάρχουν σε σχετική αφθονία. Είναι λευκά και κρυσταλλικά από την Αργεντινή. Συνδυάζονται εύκολα με οξυγόνο εάν εκτίθενται στον αέρα. Αυτό οφείλεται, εν μέρει, στο γεγονός ότι έχουν δύο ηλεκτρόνια στο τελευταίο τους κέλυφος, σύμφωνα με την ικανότητα λήψης οξυγόνου. Το βάριο είναι το πιο ενεργό στοιχείο της ομάδας, και μαζί με το ασβέστιο, είναι αυτά με τις περισσότερες βιομηχανικές εφαρμογές στην ομάδα.
Ομάδα IIIA: Στοιχεία της Γης:
Η ομάδα IIIA περιλαμβάνει τα στοιχεία Boron (B), Aluminium (Al), Gallium (Ga), Indium (In) και Thallium (Tl). Το βόριο είναι ένα μη μεταλλικό στοιχείο, το αλουμίνιο είναι αμφοτερικό (αμφιπρωτικό), δηλαδή είναι ικανό να δρα ως οξύ και ως βάση. και τα άλλα τρία είναι μεταλλικά στοιχεία. Έχουν τρία ηλεκτρόνια στο τελευταίο τους κέλυφος, δημιουργώντας ένα σθένος +3, αν και μερικές φορές το Γάλλιο δρα με σθένος +1 και +2 σε ορισμένες από τις ενώσεις του. Το βόριο είναι το μόνο στοιχείο αυτής της σειράς που σχηματίζει υδρίδια. Βόριο και αλουμίνιο σχηματίζουν καρβίδια.
Ομάδα IVA: Carbon Family:
Τα αντιπροσωπευτικά στοιχεία της ομάδας IVA είναι Carbon (C), Silicon (Si), Germanium (Ge), Tin (Sn) και Lead (Pb). Τα δύο πρώτα είναι βασικά μη μεταλλικά ως προς τα χαρακτηριστικά τους, αλλά το Germanium, το Tin και το Lead είναι μεταλλικά και, τόσο περισσότερο, τόσο υψηλότερος είναι ο ατομικός αριθμός τους. Με εξαίρεση το Silicon, κάθε στοιχείο έχει τα σθένη +4 και +2.
Ο άνθρακας και το πυρίτιο σχηματίζουν ενώσεις στις οποίες τα άτομα των στοιχείων ενώνονται από ζεύγη κοινών ηλεκτρονίων. Ο άνθρακας είναι η ουσία των οργανικών ενώσεων με τη σύνδεση με άτομα υδρογόνου, οξυγόνου, αζώτου, θείου και μερικές φορές πυριτίου.
Το πυρίτιο και το γερμάνιο χρησιμοποιούνται για την κατασκευή ηλεκτρονικών εξαρτημάτων, καθώς έχουν την ιδιότητα να συμπεριφέρονται σαν ημιαγωγοί.
Ομάδα VA: Οικογένεια αζώτου:
Η ομάδα VA περιλαμβάνει τα στοιχεία Nitrogen (N), Phosphorus (P), Arsenic (As), Antimony (Sb) and Bismuth (Bi). Το άζωτο και ο φωσφόρος είναι μη μεταλλικά, το αρσενικό και το αντιμόνιο είναι μεταλλοειδή και το βισμούθιο είναι μέταλλο Αυτά τα στοιχεία χαρακτηρίζονται από σχηματισμό υδριδίων, εκ των οποίων το λιγότερο τοξικό είναι το Ammonia NH3. Το άζωτο σχηματίζει νιτρικό οξύ HNO3, μαζί με το υδροχλωρικό οξύ στην Agua Regia, ένα μείγμα ικανό να διαλύσει πολύτιμα μέταλλα όπως ο χρυσός και ο ασήμι.
Το άζωτο εμπλέκεται επίσης σε δύο μεγάλες ομάδες οργανικών ενώσεων που ονομάζονται Αμίνες και Αμίδια, οι οποίες μπορούν να θεωρηθούν παράγωγα του Ammonia NH3, με αντικατάσταση υδρογόνου από αλυσίδα υδρογονανθράκων.
Ομάδα VIA: Οικογένεια οξυγόνου:
Αποτελείται από τα στοιχεία Oxygen (O), Sulphur (S), Selenium (Se), Tellurium (Te) και Polonium (Po). Το οξυγόνο είναι το πιο δραστικό και έχει την ικανότητα να σχηματίζει εύκολα ομοιοπολικούς δεσμούς. Σε επαφή με μέταλλα σε περιβάλλον υψηλής υγρασίας, σχηματίζει οξείδια. Σχηματίζει ένα συντονιστικό μόριο που ονομάζεται Όζον, το οποίο προστατεύει τον πλανήτη από την υπεριώδη ακτινοβολία.
Ομάδα VIIA: Αλογόνα:
Το όνομά του σημαίνει "Διαμορφωτές πωλήσεων". Η ομάδα αποτελείται από τα στοιχεία Fluor (F), Chlorine (Cl), Bromine (Br), Iodine (I) και Astate (At). Έχουν επτά ηλεκτρόνια στο τελευταίο κέλυφος, το οποίο τους επιτρέπει να είναι υποδοχείς για ένα ηλεκτρόνιο. Αυτή η ποιότητα τους κάνει να συνδέονται με τα στοιχεία της ομάδας IA, σχηματίζοντας δυαδικά άλατα. Το Fluor χαρακτηρίζεται από το ότι έχει τη μεγαλύτερη Ηλεκτρονανητικότητα ολόκληρου του Περιοδικού Πίνακα, με τιμή 4,0, με αντίστοιχο το Cesium, με ηλεκτροαρνητικότητα 0,7. Αυτή η ιδιότητα του επιτρέπει να έχει τη δύναμη να προσελκύσει άλλα άτομα και να δώσει προτεραιότητα στη δημιουργία δεσμού με αυτοί.
Ομάδα VIIIA: Ευγενή αέρια:
Ονομάζεται επίσης ομάδα αδρανούς αερίου, αποτελείται από τα στοιχεία Helium (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe) και Radon (Ra). Είναι τα στοιχεία που έχουν όλη την ηλεκτρονική τους διαμόρφωση, επομένως δεν είναι σε θέση να αντιδράσουν υπό συνήθεις συνθήκες. Χρησιμοποιούνται κυρίως για φωτεινά εμπορικά σήματα, που εκπέμπουν ορατό φως όταν υπάρχει ηλεκτρικό ρεύμα πάνω τους.
Ομάδες Β: Μεταβατικά μέταλλα:
Σε δέκα ομάδες τριών στοιχείων η καθεμία, τα μέταλλα μετάβασης ομαδοποιούνται. Αυτά περιλαμβάνουν τους καλύτερους ηλεκτρικούς αγωγούς: Ασημί (Ag), Χαλκός (Cu), Χρυσός (Au). τα καλύτερα δομικά στοιχεία για αστικές κατασκευές και μηχανική · Σίδηρος (Fe), Τιτάνιο (Ti), Αλουμίνιο (Al), Ζιρκόνιο (Zr), Βολφράμιο (W); τα καλύτερα συστατικά καταλύτη: Νικέλιο (Ni), Vanadium (V), Platinum (Pt). και τα κύρια συστατικά επίστρωσης: Κάδμιο (Cd), Chromium (Cr), Ψευδάργυρος (Zn). Συνήθως χειρίζονται σθένους μεταξύ +1 και +3, αλλά στοιχεία όπως τα σθένη χειρισμού Chromium +2, +3, +6.
Σπάνιες γαίες: Lanthanides και Actinides:
Ονομάζονται σπάνιες γαίες λόγω της έλλειψής τους στον πλανήτη. Αποτελούνται από δύο ομάδες: Lanthanides και Actinides. Βρίσκονται στις δύο ξεχωριστές γραμμές του Περιοδικού Πίνακα. Λειτουργούν με σθένος +3 γενικά και τείνουν να σχηματίζουν υδροξείδια. Το πιο σημαντικό στοιχείο μεταξύ αυτών είναι το Cerium, το οποίο χρησιμοποιείται στην παρασκευή πυροφορικών κραμάτων (Alloy) Mischmetal, για πέτρες για αναπτήρες), σε σωλήνες αερίου για φωτισμό και στην κατασκευή ειδικών γυαλιών που απορροφούν υπεριώδεις ακτίνες και ακτινοβολία θερμότητας.
Τα πιο ισχυρά ραδιενεργά στοιχεία, όπως το Ουράνιο (U) και το Πλουτώνιο (Pu), αποτελούν μέρος αυτών των ομάδων. που δεδομένης της αστάθειας, απελευθερώνουν ενέργεια και αποσυντίθενται, χάνοντας σωματίδια άλφα (πυρήνες του Ήλιο). Αργότερα γίνονται λιγότερο ασταθή στοιχεία, σύμφωνα με τη ραδιενεργή σειρά.