Παράδειγμα ογκομετρικής ανάλυσης
Χημεία / / July 04, 2021
Επί Αναλυτική χημεία, ο Ογκομετρία είναι μια μέθοδος ανάλυσης που αποτελείται από το Απαιτείται μέτρηση του όγκου του αντιδραστηρίου για να αντιδράσει στοιχειομετρικά με τον αναλυτή, που είναι η ουσία που πρέπει να προσδιοριστεί.
Αντιδράστε στοιχειομετρικά αναφέρεται στις ουσίες που αλληλεπιδρούν χημικά, σύμφωνα με το αναλογία που σηματοδοτεί τη χημική εξίσωση ήδη ισορροπημένο.
Η ουσία που πρέπει να διερευνηθεί ονομάζεται Αναλυτής. Από αυτήν την ουσία, ένας γνωστός και ακριβώς μετρημένος όγκος θα ληφθεί ως δείγμα, το οποίο θα ονομάσουμε Ομαλός διαιρέτης, περιέχεται σε μια φιάλη Erlenmeyer για να ξεκινήσει η ανάλυση.
Έννοιες Ογκομετρικής Ανάλυσης
Ογκομετρική ανάλυση, που είναι ένας τύπος Χημική ανάλυση, κουβαλάω περιελάμβανε χημική αντίδραση. Αυτή η χημική αντίδραση θα πραγματοποιηθεί μεταξύ του δείγματος με άγνωστη ποσότητα της εξεταζόμενης ουσίας και με γνωστή ποσότητα άλλης ουσίας, ικανή να αντιδράσει με την πρώτη.
ο Οι ουσίες αντίδρασης θα βρίσκονται σε υδατικό διάλυμα, και θα μετρηθούν οι όγκοι των διαλυμάτων που αλληλεπίδρασαν για να φτάσουν στο τέλος της αντίδρασης, οι οποίες θα είναι ορατές χάρη σε έναν δείκτη που θα δώσει χρώμα μέσα στη φιάλη.
Στην ογκομετρική ανάλυση, το υδατικό διάλυμα του Η Γνωστή Συγκέντρωση ονομάζεται Τυπική Λύση, Τυπικό ή τιτανίου, και θα χρησιμεύσει ως αναφορά, για τον τερματισμό της αντίδρασης, για τον υπολογισμό που θα αποκαλύψει την ποσότητα της υπό εξέταση ουσίας.
Αυτή η διαδικασία για την αντίδραση και των δύο λύσεων καλείται Χημικός βαθμός Αποτίμηση, η οποία είναι το θεμελιώδες μέρος της Ογκομετρικής Ανάλυσης. Αποτελείται από τη μετάβαση σταδιακά χύνοντας την τυπική λύση (Τίτλος) στο κλάσμα (Δείγμα), έως ότου η ένδειξη δείξει την αλλαγή με διαφορά χρώματος.
ΕΝΑ Δείκτης Είναι μια χημική ουσία που προστίθεται στο Aliquot, που δείχνει χρωματισμό και ότι όταν τελειώσει η αντίδραση, θα αλλάξει χρώμα.
Η ογκομετρική ανάλυση αποτελείται από μια απλή σειρά βημάτων:
1.- Προετοιμασία τυπικού διαλύματος
2.- Προετοιμασία του δείγματος ή του δείγματος
3.- Χημικός βαθμός
4.- Μέτρηση όγκου
5.- Υπολογισμός της εξεταζόμενης ουσίας.
Στο σημείο που έχουν ήδη αντέδρασε πλήρως οι δύο ουσίες, λέγεται Σημείο ισοδυναμίας.
Όπως σε οποιαδήποτε χημική μέθοδο ανάλυσης, στην ογκομετρική ανάλυση υπάρχουν απαιτήσεις για καλά αποτελέσματα:
-Η χημική αντίδραση πρέπει να είναι ΕκλεκτικόςΔηλαδή, η τυπική λύση θα αντιδράσει μόνο με το δείγμα.
-Η χημική αντίδραση πρέπει να είναι Στοιχειομετρική, δηλαδή, ακολουθήστε τις αναλογίες που σημειώνονται στην ισορροπημένη χημική εξίσωση.
-Η χημική αντίδραση πρέπει να είναι Ποσοτικός; αναφέρεται στην ολοκλήρωση 99,9% στο σημείο ισοδυναμίας.
- Πρέπει να υπάρχει ανιχνεύσιμο τελικό σημείο στην αντίδραση, το οποίο θα επιβεβαιωθεί καλύτερα από τον δείκτη.
Πρωτεύον μοτίβο
ο Πρωτεύοντα μοτίβα Είναι ουσίες υψηλής καθαρότητας των οποίων η συγκέντρωση σε διάλυμα υπολογίζεται απευθείας από την ποσότητα που ζυγίζεται και τον όγκο του νερού που χρησιμοποιείται.
Α) Ναι, μπορεί να αντιδράσει με λύσεις εργασίας, να γνωρίζουμε τις συγκεντρώσεις των τελευταίων και να τις μετατρέπουμε σε τυποποιημένες λύσεις.
Παραδείγματα πρωτογενών μοτίβων είναι:
-Ανθρακικό νάτριο (Na2CO3): Χρησιμοποιείται για την τυποποίηση οξέων, όπως το θειικό οξύ.
- Διφθαλικό κάλιο: Είναι το πρωταρχικό πρότυπο για την παρασκευή τυποποιημένων διαλυμάτων βάσεων, όπως το υδροξείδιο του νατρίου.
-Χλωριούχο νάτριο (NaCl): Χρησιμοποιείται για την τυποποίηση των διαλυμάτων νιτρικού αργύρου.
-Ανθρακικό ασβέστιο (CaCO3): Πρωταρχικό πρότυπο για EDTA (αιθυλενοδιαμίνη τετραοξικό οξύ).
Ένα πρωτεύον μοτίβο πρέπει να πληροί πολλά βασικά χαρακτηριστικά:
Πρέπει να έχετε ένα Υψηλή καθαρότητα, Ατμοσφαιρική σταθερότητα, Απουσία νερού ενυδάτωσης, Χαμηλό κόστος και εύκολο στη λήψηΓ Υψηλό ισοδύναμο βάρος.
Ταξινόμηση της Ογκομετρικής Ανάλυσης
Ανάλογα με τα χημικά είδη με τα οποία εργάζεστε για να κάνετε μια ανάλυση, θα είναι ο τύπος της ογκομετρίας:
Ογκομετρία οξέος-βάσης: Λειτουργεί, είτε με οξύ είτε με βάση, για την ανάλυση δειγμάτων που περιέχουν οξέα ή βάσεις.
Ογκομετρία υετού: Ονομάζεται επίσης Argentometry, χρησιμοποιεί μια τυπική λύση νιτρικού αργύρου για να προσδιορίσει πόσα χλωρίδια υπάρχουν σε ένα δείγμα.
Ογκομετρία πολυπλοκότητας: Μια τυπική λύση ενός παράγοντα συμπλοκοποίησης, όπως το EDTA, χρησιμοποιείται για τη μέτρηση της συγκέντρωσης της σκληρότητας, δηλαδή του ανθρακικού ασβεστίου και του μαγνησίου, στο νερό.
Ογκομετρία REDOX: Η αντίδραση συμβαίνει μεταξύ μιας οξειδωτικής ουσίας και μιας αναγωγικής ουσίας.
Δείκτες
Από τους πολυάριθμους δείκτες που χρησιμοποιούνται στο Volumetrics, τρεις ξεχωρίζουν:
1.- Πορτοκάλι μεθυλίου: Χρειάζεται ένα πορτοκαλί χρώμα στο κλάσμα, το οποίο θα τιτλοδοτηθεί με ένα οξύ. Όταν επιτευχθεί το σημείο ισοδυναμίας, η ένδειξη θα γίνει κίτρινη.
2.- Φαινοφθαλίνη: Είναι διαφανές στην αρχή στο κλάσμα, το οποίο θα έχει τίτλο με βάση. Όταν επιτευχθεί το σημείο ισοδυναμίας, η ένδειξη θα γίνει ροζ.
3.- Eriochrome Black: Είναι ο δείκτης που χρησιμοποιείται για τον προσδιορισμό της σκληρότητας στο νερό. Στην αρχή είναι μωβ στο κλάσμα, έως ότου τιτλοδοτηθεί με έναν παράγοντα συμπλοκοποίησης. Στο τέλος της αντίδρασης, γίνεται μπλε.

Όργανα σε ογκομετρική ανάλυση
Σε μια ογκομετρική ανάλυση, θα χρησιμοποιηθεί μια σειρά οργάνων που, εάν δεν είναι διαθέσιμα, δεν μπορούν να αναπτυχθούν επαρκώς:
1.- Ογκομετρική φιάλη: Είναι ένα δοχείο σαν βολβός στο κάτω μέρος του, ισιωμένος στο κάτω μέρος, ο οποίος έχει μια λεπτή στήλη στην οποία προστίθεται το υγρό. Έχει ένα σημάδι που υποδεικνύει πού πρέπει να είναι ο μηνίσκος του υγρού, έτσι ώστε να καλύπτει τον ακριβή όγκο. Χρησιμοποιείται για να περιέχει τυπικές λύσεις. Χάρη στην ακρίβεια του όγκου του, εξασφαλίζεται μια γνωστή συγκέντρωση.

2.- Πιπέτες: Είναι διαβαθμισμένοι λεπτοί σωλήνες που επιτρέπουν τη μέτρηση αξιόπιστων ακριβών ποσοτήτων υγρού. Διατίθενται έως και 25 ml και επιτρέπουν ακριβή δειγματοληψία.
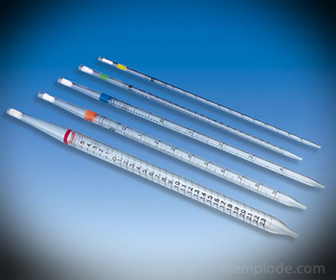
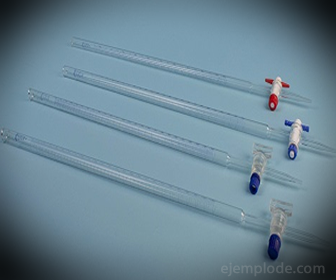
3.- Burette: Πρόκειται για έναν επιμήκη σωλήνα χωρητικότητας 50 ml, ο οποίος θα περιέχει το πρότυπο διάλυμα. Σε ένα από τα άκρα του έχει μια βαλβίδα ρύθμισης της ροής που θα αποστραγγίσει το διάλυμα στο Aliquot.
4.- Φιάλες Erlenmeyer: Είναι δοχεία με επίπεδη βάση, κωνικό σχήμα που καταλήγει σε κυλινδρικό άκρο. Αυτός ο σχεδιασμός τα καθιστά κατάλληλα για χημικές τιτλοδοτήσεις, καθώς δεν επιτρέπουν την ανακίνηση των διαλυμάτων. Θα απαιτηθούν τουλάχιστον τρία εάν πρέπει να γίνουν επαναλαμβανόμενες δοκιμές, για να εξασφαλιστεί ένα αξιόπιστο αποτέλεσμα.

Υπολογισμοί σε ογκομετρική ανάλυση
Καθώς αντιμετωπίζονται υδατικά διαλύματα, οι ποσότητες σπουδαιότητας για μια ογκομετρική ανάλυση είναι η συγκέντρωση και ο όγκος.
Η κύρια εξίσωση της Ογκομετρίας βασίζεται σε τέσσερα κύρια δεδομένα:
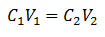
ντο1= Συγκέντρωση δείγματος (άγνωστο)
Β1= Όγκος του Aliquot, με τον οποίο έγινε η ανάλυση
ντο2= Συγκέντρωση τυπικού διαλύματος που χρησιμοποιείται για την επίτευξη του σημείου ισοδυναμίας
Β2= Απαιτείται τυπική λύση όγκου για να φτάσει στο τέλος της αντίδρασης
Τα δεδομένα αντικαθίστανται στην εξίσωση, αφήνοντας μόνο τη συγκέντρωση που ζητήθηκε ως άγνωστη. Φυσικά, όλα τα δεδομένα πρέπει να βρίσκονται στις ίδιες μονάδες δίσκου.
Παραδείγματα ογκομετρικής ανάλυσης
Προσδιορισμός χλωριδίων (Cl-) με Argentometry, με νιτρικό άργυρο.
Προσδιορισμός των βρωμιδίων (Br-) με Argentometry, με νιτρικό άργυρο.
Προσδιορισμός των κυανιδίων (CN-) με Argentometry, με νιτρικό άργυρο.
Προσδιορισμός ανθρακικού μαγνησίου (MgCO3), με Συμπλοκομετρία, με EDTA.
Προσδιορισμός ανθρακικού ασβεστίου (CaCO3), με Συμπλοκομετρία, με EDTA.
Ανάλυση θειικού οξέος (Η2ΝΔ4) με υδροξείδιο του νατρίου (NaOH).
Ανάλυση υδροξειδίου του νατρίου (NaOH) με υδροχλωρικό οξύ (HCl).
Προσδιορισμός αντιμονίου (III) με υπερμαγγανικό κάλιο (KMnO4).
Προσδιορισμός αρσενικού (III) με υπερμαγγανικό κάλιο (KMnO4).
Προσδιορισμός τιτανίου (III) με υπερμαγγανικό κάλιο (KMnO4).
Προσδιορισμός του μολυβδαινίου (III) με υπερμαγγανικό κάλιο (KMnO4).
Προσδιορισμός του σιδήρου (II) με υπερμαγγανικό κάλιο (KMnO4).
Προσδιορισμός οξαλικού ιόντος με υπερμαγγανικό κάλιο (KMnO4).
