Παράδειγμα ομοιοπολικού δεσμού
Χημεία / / July 04, 2021
ο Ομοιοπολικό δεσμό είναι αυτό στο οποίο δύο άτομα ενώνονται μοιράζονται τα ηλεκτρόνια τους, για να ολοκληρώσετε τους Κανόνες σας για την Οκτάτη.
Ιστορία του ομοιοπολικού δεσμού
Στις αρχές του 20ου αιώνα άρχισαν να καταλαβαίνουν οι χημικοί πώς και γιατί σχηματίστηκαν μόρια. Η πρώτη σημαντική ανακάλυψη ήρθε με την πρόταση του Gilbert Lewis για τι ο σχηματισμός ενός χημικού δεσμού υπονοεί πως άτομα μοιράζονται ηλεκτρόνια. Ο Lewis περιέγραψε τον σχηματισμό ενός χημικού δεσμού στο υδρογόνο ως:
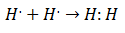
Αυτός ο τύπος ζευγαρώματος ηλεκτρονίων είναι ένα παράδειγμα ενός ομοιοπολικού δεσμού, ενός δεσμού στον οποίο δύο ηλεκτρόνια μοιράζονται από δύο άτομα. ο Ομοιοπολικές ενώσεις Είναι αυτό περιέχουν μόνο ομοιοπολικούς δεσμούς.
Ηλεκτρόνια στο ομοιοπολικό δεσμό
Για απλότητα, το κοινό ζεύγος ηλεκτρονίων αντιπροσωπεύεται συχνά ως μονή γραμμή σύνδεση των συμβόλων των στοιχείων. Έτσι, ο ομοιοπολικός δεσμός του μορίου υδρογόνου γράφεται ως Η-Η.
Στον ομοιοπολικό δεσμό, κάθε ηλεκτρόνιο του κοινού ζεύγους προσελκύεται στους πυρήνες και των δύο ατόμων
. Αυτή η έλξη συγκρατεί τα δύο άτομα στο μόριο Η μαζί.2 και είναι υπεύθυνη για το σχηματισμό ομοιοπολικών δεσμών σε άλλα μόρια.Στους ομοιοπολικούς δεσμούς μεταξύ ατόμων πολλών ηλεκτρονίων συμμετέχουν μόνο ηλεκτρόνια σθένους, τα οποία είναι τα πιο απομακρυσμένα, στη ρηχή τροχιά. Μεταξύ ενός και τριών από αυτούς θα συμμετάσχουν στην ένωση.
Τα άλλα ηλεκτρόνια, που δεν συμμετέχουν στον δεσμό, καλούνται Ηλεκτρόνια χωρίς σύνδεση, ή αν τα οργανώσουμε σε ζευγάρια, Δωρεάν ζευγάρια. Δηλαδή, ζευγάρια Valencia Electrons που μην συμμετέχετε στο σχηματισμό ομοιοπολικού δεσμού.
Αναπαράσταση ομοιοπολικών ομολόγων
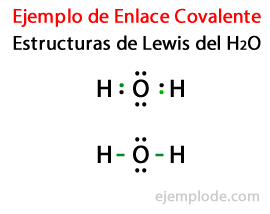
Οι δομές με τις οποίες παριστάνονται ομοιοπολικές ενώσεις, όπως Η2 και ΣΤ2 είναι γνωστά ως Δομές Lewis. Μια δομή Lewis είναι ένα αναπαράσταση ενός ομοιοπολικού δεσμού, όπου το ζεύγος κοινών ηλεκτρονίων υποδεικνύεται με γραμμές ή ως ζεύγη σημείων μεταξύ δύο ατόμωνκαι τα ελεύθερα ελεύθερα ζεύγη υποδεικνύονται ως ζεύγη σημείων στα μεμονωμένα άτομα. Σε μια δομή Lewis, εμφανίζονται μόνο τα ηλεκτρόνια σθένους και όχι τα εσωτερικά.
Λαμβάνοντας υπόψη τη δομή Lewis για το μόριο νερού Η2Ή, όλα τα ηλεκτρόνια σθένους των ατόμων υδρογόνου και οξυγόνου επισημαίνονται πρώτα με τελείες.
Σε μια δεύτερη περίπτωση, ο σύνδεσμος επισημαίνεται με μια γραμμή. Και τα ελεύθερα ζευγάρια, τα οποία θα υπάρχουν μόνο στο οξυγόνο, με σημεία.
Ο κανόνας του οκτάτου
Ο σχηματισμός αυτών των μορίων, όπως αυτά του Water H2Ή, απεικονίστε την κλήση Κανόνας οκτάδας, που προτείνει ο Lewis: Ένα άτομο διαφορετικό από το υδρογόνο τείνει να σχηματίζει δεσμούς έως ότου περιβάλλεται οκτώ ηλεκτρόνια σθένουςΔηλαδή, ένας ομοιοπολικός δεσμός σχηματίζεται όταν δεν υπάρχουν αρκετά ηλεκτρόνια για κάθε άτομο για να ολοκληρώσει την οκτάδα του.
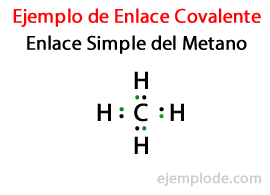
Με την κοινή χρήση ηλεκτρονίων σε έναν ομοιοπολικό δεσμό, κάθε άτομο ολοκληρώνει το οκτάτο του. Για το υδρογόνο, η απαίτηση είναι να αποκτήσετε την ηλεκτρονική διαμόρφωση του Helium, που θα έχει συνολικά δύο ηλεκτρόνια.
Ο κανόνας οκτάδας λειτουργεί κυρίως για τα στοιχεία της δεύτερης περιόδου ή της σειράς του περιοδικού πίνακα. Αυτά τα στοιχεία έχουν υποεπίπεδα στα οποία μπορεί να υπάρχουν συνολικά οκτώ ηλεκτρόνια.
Όταν ένα άτομο αυτών των στοιχείων σχηματίζει μια ομοιοπολική ένωση, αποκτά την ηλεκτρονική διαμόρφωση του αερίου Neon Noble, μοιράζοντας ηλεκτρόνια με άλλα άτομα στην ίδια ένωση.
Τύποι ομοιοπολικών δεσμών
Τα άτομα μπορούν να σχηματίσουν διαφορετικούς τύπους ομοιοπολικών δεσμών: Μονά, Διπλά ή Τρίκλινα.
Σε ένα Απλός σύνδεσμος, δύο άτομα ενώνονται μέσω του Ένα ζεύγος ηλεκτρονίων. Εμφανίζονται στη συντριπτική πλειονότητα των ομοιοπολικών ενώσεων και είναι η πιο βασική μορφή αυτού του δεσμού.
Σε πολλές ενώσεις, Διπλοί σύνδεσμοι, δηλαδή, όταν μοιράζονται δύο άτομα Δύο ζεύγη ηλεκτρονίων. Εάν δύο άτομα μοιράζονται δύο ζεύγη ηλεκτρονίων, ο ομοιοπολικός δεσμός ονομάζεται διπλό δεσμό. Αυτοί οι δεσμοί βρίσκονται σε μόρια όπως το διοξείδιο του άνθρακα (CO2) και αιθυλένιο (C2Η4).

ΕΝΑ Τριπλή σύνδεση προκύπτει όταν μοιράζονται δύο άτομα Τρία ζεύγη ηλεκτρονίων, όπως στο μόριο Ν αζώτου2, το μόριο ακετυλενίου C2Η2.

Οι πολλαπλοί δεσμοί είναι μικρότεροι από τους απλούς ομοιοπολικούς δεσμούς. ο Μήκος συνδέσμου ορίζεται ως το απόσταση μεταξύ του πυρήνα των δύο ενωμένων ατόμων με έναν ομοιοπολικό δεσμό σε ένα μόριο.
Διαφορές μεταξύ ομοιοπολικών και ιοντικών ενώσεων
Οι ιονικές και ομοιοπολικές ενώσεις παρουσιάζουν σημαντικές διαφορές στις γενικές φυσικές τους ιδιότητες, λόγω του γεγονότος ότι οι δεσμοί τους είναι διαφορετικής φύσης.
Στο Ομοιοπολικές ενώσεις υπάρχει δύο τύποι ελκυστικών δυνάμεων; ένα από αυτά είναι αυτό που συγκρατεί τα άτομα ενός μορίου. Ένα ποσοτικό μέτρο αυτής της έλξης είναι το δεσμευτική ενέργεια. Η άλλη δύναμη έλξης λειτουργεί μεταξύ των πλήρων μορίων και ονομάζεται Διαμοριακή δύναμη. Δεδομένου ότι οι Διαμοριακές Δυνάμεις είναι συνήθως ασθενέστερες από τις δυνάμεις που συγκρατούν τα άτομα ενός μορίου μαζί, τα μόρια μιας ομοιοπολικής ένωσης συνδέονται με λιγότερη δύναμη.
Υπό την έννοια, Οι ομοιοπολικές ενώσεις είναι σχεδόν πάντα αέρια χαμηλής τήξης, υγρά ή στερεάν. Από την άλλη πλευρά, οι ηλεκτροστατικές δυνάμεις που συγκρατούν τα ιόντα μαζί σε μια ιοντική ένωση είναι συνήθως πολύ ισχυρές, έτσι ώστε οι ιοντικές ενώσεις να είναι στερεές σε θερμοκρασία δωματίου και να έχουν υψηλά σημεία τήξης. Πολλές ιονικές ενώσεις είναι διαλυτές στο νερό και τα υδατικά διαλύματά τους μεταφέρουν ηλεκτρισμό επειδή αυτές οι ενώσεις είναι ισχυροί ηλεκτρολύτες.
Οι περισσότεροι απο Οι ομοιοπολικές ενώσεις είναι αδιάλυτες στο νερό, και εάν διαλύονται, τις υδατικές λύσεις του ως συνήθως δεν μεταφέρουν ηλεκτρισμό επειδή αυτές οι ενώσεις είναι μη-ηλεκτρολύτες. Οι λιωμένες ιοντικές ενώσεις μεταφέρουν ηλεκτρισμό επειδή περιέχουν κατιόντα και ανιόντα που κινούνται ελεύθερα υγρές ή λιωμένες ομοιοπολικές ενώσεις δεν αγωγούν ηλεκτρισμό επειδή δεν υπάρχουν ιόντα.
Παραδείγματα ομοιοπολικώς συνδεδεμένων ενώσεων
- Ακετυλένιο Γ2Η2
- Μεθάνιο CH4
- Αιθάνιο Γ2Η6
- Προπάνιο Γ3Η8
- Βουτάνιο Γ4Η10
- Βενζόλιο C.6Η6
- Τολουόλιο Γ7Η8
- Μεθυλική αλκοόλη CH3Ω
- Αιθυλική αλκοόλη Γ2Η5Ω
- Προπυλική αλκοόλη Γ3Η7Ω
- Μεθυλ αιθέρας CH3Ωχ3
- Μεθυλ αιθυλ αιθέρας C2Η5Ωχ3
- Αιθυλ Αιθέρας Γ2Η5ΟΚ2Η5
- Φορμικό οξύ HCOOH
- Οξεικό οξύ CH3COOH
- Προπιονικό οξύ C2Η5COOH
- Βουτυρικό οξύ C3Η7COOH
- Διοξείδιο του άνθρακα CO2
- Μονοξείδιο του άνθρακα CO
- Μοριακό άζωτο Ν2
- Μοριακό υδρογόνο Η2