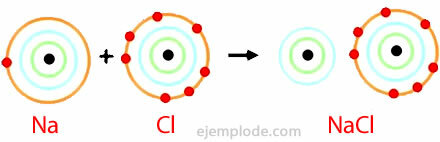
Παράδειγμα ιονικού δεσμού
Χημεία / / July 04, 2021
Ο ιονικός δεσμός δίνεται από την παρουσία κατιόντος και ανιόντος, χημικού είδους με ηλεκτρικά φορτία αντίθετων σημείων. Ορίζεται ως η ηλεκτροστατική δύναμη που δεσμεύει τα ιόντα σε μια ιοντική ένωση.
Άτομα στοιχείων με χαμηλές ενέργειες ιονισμού τείνουν να σχηματίζουν κατιόντα. Αντίθετα, εκείνοι με υψηλή συγγένεια ηλεκτρονίων τείνουν να σχηματίζουν ανιόντα.
Τα μέταλλα αλκαλίων και αλκαλικών γαιών είναι πιο πιθανό να σχηματίσουν κατιόντα σε ιοντικές ενώσεις και τα αλογόνα και το οξυγόνο είναι πιο πιθανό να σχηματίσουν ανιόντα. Κατά συνέπεια, η σύνθεση μιας μεγάλης ποικιλίας ιοντικών ενώσεων προκύπτει από το συνδυασμό ενός μετάλλου ομάδας ΙΑ ή IIΑ και ενός αλογόνου ή οξυγόνου.
Για παράδειγμα, η αντίδραση μεταξύ λιθίου και φθορίου παράγει λίθιο φθοριούχο, μια δηλητηριώδη λευκή σκόνη που χρησιμοποιείται για τη μείωση του σημείου τήξης της κόλλησης και στην κατασκευή κεραμικών. Η ηλεκτρονική διαμόρφωση του λιθίου είναι 1s2, 2 δευτερόλεπτα1, και αυτό του φθορίου είναι 1s2, 2 δευτερόλεπτα2, 2 σελ
5. Όταν αυτά τα άτομα έρχονται σε επαφή, το ηλεκτρόνιο σθένους 2s1 Το λίθιο μεταφέρεται στο άτομο φθορίου.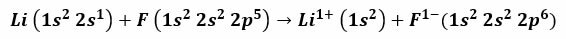
Είναι σωστό να υποθέσουμε ότι η διαδικασία ξεκινά με την αποκόλληση του ηλεκτρονίου λιθίου, ιονίζοντάς το για να φτάσει στο θετικό σθένος 1+. Συνεχίζει με τη λήψη αυτού του ηλεκτρονίου από το φθόριο, το οποίο του δίνει αρνητικό φορτίο. Στο τέλος, ο σχηματισμός του ιοντικού δεσμού λαμβάνει χώρα με ηλεκτροστατική έλξη. Η ένωση φθοριούχου λιθίου θα είναι ηλεκτρικά ουδέτερη.
Πολλές κοινές αντιδράσεις οδηγούν στο σχηματισμό ιοντικών δεσμών. Για παράδειγμα, η καύση του ασβεστίου στο οξυγόνο παράγει οξείδιο του ασβεστίου:
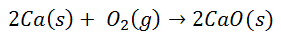
Το μόριο διατομικού οξυγόνου διαχωρίζεται σε δύο μεμονωμένα άτομα. Τότε θα υπάρξει μεταφορά δύο ηλεκτρονίων από το άτομο ασβεστίου σε κάθε άτομο οξυγόνου. Και οι δύο θα έχουν τότε τις αντίστοιχες χρεώσεις τους: για το ασβέστιο 2+ για κάθε άτομο και για το οξυγόνο 2- για κάθε άτομο. Κατά την τελική συγκόλληση, το μόριο Οξειδίου του Ασβεστίου είναι ηλεκτρικά ουδέτερο.
Ενέργεια πλέγματος ιόντων ενώσεων
Με τις τιμές ιονισμού ενέργειας και συγγένειας ηλεκτρονίων των στοιχείων είναι δυνατό να προβλέψουμε τι στοιχεία σχηματίζουν ιοντικές ενώσεις, αλλά είναι επίσης απαραίτητο να αξιολογηθεί η σταθερότητα αυτού του τύπου ενώσεις.
Η ενέργεια ιονισμού και η συγγένεια ηλεκτρονίων ορίζονται για διεργασίες που συμβαίνουν στην αέρια φάση, αν και όλες οι ιοντικές ενώσεις είναι στερεές σε 1 ατμόσφαιρα πίεσης και 25 ° C. Η στερεά κατάσταση είναι μια πολύ διαφορετική κατάσταση επειδή κάθε κατιόν περιβάλλεται από έναν συγκεκριμένο αριθμό ανιόντων και αντίστροφα. Κατά συνέπεια, η συνολική σταθερότητα της στερεάς ιοντικής ένωσης εξαρτάται από τις αλληλεπιδράσεις όλων των ιόντων και όχι μόνο από την αλληλεπίδραση ενός κατιόντος με ένα ανιόν.
Ένα ποσοτικό μέτρο της σταθερότητας οποιουδήποτε ιοντικού στερεού είναι το πλέγμα ενέργειας, που ορίζεται ως Η ενέργεια που απαιτείται για τον πλήρη διαχωρισμό ενός γραμμομορίου στερεάς ιονικής ένωσης στα ιόντα του στην αέρια κατάσταση.
Κύκλος Born-Haber για τον προσδιορισμό της ενέργειας του πλέγματος
Δεν είναι δυνατή η άμεση μέτρηση της ενέργειας του πλέγματος. Ωστόσο, εάν η δομή και η σύνθεση μιας ιοντικής ένωσης είναι γνωστές, είναι εφικτό να υπολογιστεί η ενέργεια του δικτυωτού πλέγματος εφαρμόζοντας τον νόμο του Coulomb, ο οποίος δηλώνει ότι η δυνητική ενέργεια μεταξύ δύο ιόντων είναι άμεσα ανάλογη με το προϊόν των φορτίων τους και αντιστρόφως ανάλογη με την απόσταση μεταξύ τους. Να σταματήσει.
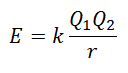
Δεδομένου ότι η χρέωση του Κατιόντος είναι θετική και αυτή του Ανιόν είναι αρνητική, το προϊόν θα δώσει αρνητικό αποτέλεσμα στην Ενέργεια. Αυτό αντιπροσωπεύει μια εξώθερμη αντίδραση. Κατά συνέπεια, για να αντιστραφεί η διαδικασία, πρέπει να παρέχεται ενέργεια.
Είναι επίσης εφικτό να προσδιοριστεί έμμεσα η ενέργεια του δικτυωτού πλέγματος εάν υποτεθεί ότι μια ιοντική ένωση σχηματίζεται σε διάφορα στάδια. Αυτή η διαδικασία είναι γνωστή ως Κύκλος Born-Haber, η οποία συσχετίζει τις ενέργειες πλέγματος των ιοντικών ενώσεων με τις ενέργειες ιονισμού, την ηλεκτρονική συγγένεια και άλλες ατομικές και μοριακές ιδιότητες. Αυτή η μέθοδος βασίζεται στον νόμο του Χέσι για το αλγεβρικό άθροισμα των χημικών αντιδράσεων και αναπτύχθηκε από τους Max Born και Fritz Haber. Ο κύκλος Born-Haber καθορίζει τα διαφορετικά στάδια που προηγούνται του σχηματισμού ενός ιοντικού στερεού.

Χλωριούχο νάτριο
Το χλωριούχο νάτριο είναι μια ιοντική ένωση με σημείο τήξης 801 ° C, η οποία διοχετεύει ηλεκτρισμό στην τετηγμένη κατάσταση και σε υδατικό διάλυμα. Το αλάτι του βράχου είναι μία από τις πηγές χλωριούχου νατρίου και βρίσκεται σε υπόγεια κοιτάσματα πάχους αρκετών εκατοντάδων μέτρων. Το χλωριούχο νάτριο λαμβάνεται επίσης από θαλασσινό νερό ή από άλμη (πυκνό διάλυμα NaCl) με ηλιακή εξάτμιση. Επίσης, βρίσκεται στη φύση στο ορυκτό που ονομάζεται Halite.

Το χλωριούχο νάτριο χρησιμοποιείται περισσότερο από οποιοδήποτε άλλο υλικό στην παρασκευή ανόργανων χημικών ενώσεων. Η παγκόσμια κατανάλωση αυτής της ουσίας είναι περίπου 150 εκατομμύρια τόνοι ετησίως. Το χλωριούχο νάτριο χρησιμοποιείται κυρίως στην παραγωγή άλλων ανόργανων χημικών ενώσεων, όπως αέριο χλώριο, υδροξείδιο νατρίου, μεταλλικό νάτριο, αέριο υδρογόνο και ανθρακικό νάτριο. Χρησιμοποιείται επίσης για την τήξη πάγου και χιονιού σε αυτοκινητόδρομους και δρόμους.