Παράδειγμα χημικής ενέργειας
Χημεία / / July 04, 2021
ο Η χημική ενέργεια είναι αυτή που προέρχεται από χημικές αντιδράσεις. Η αλληλεπίδραση μεταξύ χημικών ειδών δημιουργεί θραύση ή / και δημιουργία δεσμών, πράγμα που συνεπάγεται απελευθέρωση ή απορρόφηση Ενέργειας, αντίστοιχα. Η Χημική Ενέργεια ονομάζεται απελευθερωμένη ενέργεια, η οποία μπορεί να χρησιμοποιηθεί ως Θερμική Ενέργεια και Ηλεκτρική Ενέργεια, για παράδειγμα.
Ενέργεια σε χημικές αντιδράσεις
Η χημική ενέργεια μπορεί να ληφθεί στη μέγιστη έκφρασή της από δύο κύριες πηγές: καύση και ηλεκτρολυτικά διαλύματα. Από την άλλη πλευρά, στο επίπεδο του ανθρώπινου σώματος, είναι δυνατή η απόκτηση ενέργειας μέσω της χημικής αποσύνθεσης των τροφίμων.
Ενέργεια καύσης
Για παράδειγμα, όταν το Fuel Methane CH4, ο απλούστερος υδρογονάνθρακας, αρχίζει να καίει παρουσία του Οξειδωτικού Οξυγόνου, θα αποσυντεθεί, για να σχηματίσει προϊόντα διοξειδίου του άνθρακα CO.2 και νερό Η2Ή. Επιπλέον, η διάσπαση των δεσμών των ατόμων υδρογόνου με τα άτομα άνθρακα θα απελευθερώσει ενέργεια με τη μορφή θερμότητας.
Χ.Χ.4 (ζ) + 2O2 (ζ) → CO2 (ζ) + 2Η2 O (l) ΔH = -212,8 Kcal / mol
Εξίσωση καύσης μεθανίου. Η θερμότητα αυτής της αντίδρασης αντιπροσωπεύεται από ΔΗ. Το αρνητικό πρόσημο δείχνει την απελευθέρωση της Ενέργειας. Η αντίδραση είναι εξωθερμική.
 Καύση αερίου μεθανίου. Η αντίδραση εκδηλώνεται με φλόγα.
Καύση αερίου μεθανίου. Η αντίδραση εκδηλώνεται με φλόγα.
Παραδείγματα θερμότητας καύσης οργανικών ενώσεων στους 25 ° C.
Χημική ένωση |
Τύπος |
ΔΗ (Kcal / mol) |
Μεθάνιο (g) |
Χ.Χ.4 |
-212.80 |
Αιθάνιο (g) |
ντο2Η6 |
-372.82 |
Προπάνιο (g) |
ντο3Η8 |
-530.60 |
ν-βουτάνιο (g) |
ντο4Η10 |
-687.98 |
ν-Πεντάνιο (g) |
ντο5Η12 |
-845.16 |
Αιθυλένιο (g) |
ντο2Η4 |
-337.23 |
Ακετυλένιο (g) |
ντο2Η2 |
-310.62 |
Βενζόλιο (g) |
ντο6Η6 |
-787.20 |
Βενζόλιο (l) |
ντο6Η6 |
-780.98 |
Τολουόλιο (l) |
ντο7Η8 |
-934.50 |
Ναφθαλίνη |
ντο10Η8 |
-1,228.18 |
Σακχαρόζη |
ντο12Η22Ή11 |
-1,348.90 |
Μεθανόλη (l) |
Χ.Χ.3Ω |
-173.67 |
Αιθανόλη (l) |
ντο2Η5Ω |
-326.70 |
Οξεικό οξύ (l) |
Χ.Χ.3COOH |
-208.34 |
Βενζοϊκό οξύ |
ντο6Η5COOH |
-771.20 |
Για ένα καύσιμο που παρέχει όλη τη θερμότητα της καύσης της οποίας είναι ικανή, πρέπει να βρίσκεται σε αέρια κατάσταση. Όπως φαίνεται στον πίνακα, το υγρό βενζόλιο συμβάλλει σε θερμότητα καύσης που είναι 6,22 Kcal / mol μικρότερη από εκείνη που απελευθερώνεται από αέριο βενζόλιο. Αυτό σημαίνει ότι πρέπει να επενδυθούν 6,22 Kcal / mol για να γίνει η αλλαγή από υγρό σε αέριο.
Κάντε κλικ για περισσότερες πληροφορίες σχετικά με το Καύσιμα.
Ηλεκτρολυτικές λύσεις Ενέργεια
Ένας ηλεκτρολυτικός αγωγός είναι ένα μέσο στο οποίο εμπλέκεται ένα ή περισσότερα ιοντικά είδη, δηλαδή διασκορπίζεται με το ηλεκτρικό του φορτίο, επιτρέποντας σε ένα ηλεκτρικό ρεύμα να περάσει από αυτό Σύνταγμα. Οι ηλεκτρολυτικές λύσεις είναι ηλεκτρολυτικοί αγωγοί.
Οι ηλεκτρολυτικοί αγωγοί περιλαμβάνουν, εκτός από τα διαλύματα ηλεκτρολυτών, Λιωμένα άλατα, και επίσης μερικά στερεά άλατα, όπως χλωριούχο νάτριο NaCl και νιτρικό άργυρο ΑΓΝΟ3.
Η μεταφορά ηλεκτρονίων πραγματοποιείται με ιοντική μετανάστευση, θετική και αρνητική, προς τα ηλεκτρόδια. Αυτή η μετανάστευση περιλαμβάνει όχι μόνο μεταφορά ηλεκτρικής ενέργειας, αλλά και μεταφορά της ύλης από το ένα μέρος του αγωγού στο άλλο.
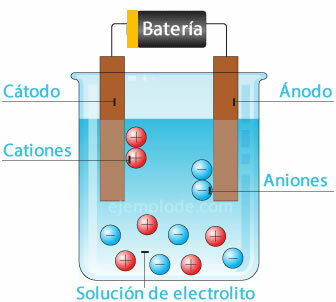 Ηλεκτροχημική κυψέλη
Ηλεκτροχημική κυψέλη
Σύνδεση μιας πιθανής πηγής με τα μεταλλικά ηλεκτρόδια (Cathode και Anode) και βύθιση αυτών στο a Υδατικό διάλυμα, τα ηλεκτρόνια θα διασχίσουν την άνοδο, για να διαφύγουν από το διάλυμα στον θετικό πόλο του κρήνη. Αυτό συμβαίνει, για παράδειγμα, με ένα ιόν χλωριδίου, το οποίο απελευθερώνεται από το ηλεκτρόνιο του, και ήδη με ουδέτερο φορτίο, ενώνει ένα άλλο άτομο χλωρίου, για να σχηματίσει το διατομικό μόριο. Το αέριο χλώριο θα διαφύγει από το διάλυμα.
2Cl- = 2Cl + 2e-
Τα ηλεκτρόνια που εξέρχονται από τον αρνητικό πόλο της πηγής θα τοποθετηθούν στην καταδυμένη κάθοδο. Τα είδη που υπάρχουν στο υδατικό διάλυμα (ιόντα) θα πάρουν τα ηλεκτρόνια από την κάθοδο. Για παράδειγμα, τα ιόντα υδρογόνου που συνθέτουν το νερό, έχοντας θετικό φορτίο, πήραν ένα ηλεκτρόνιο που θα εξουδετερωθεί και ενώθηκε με ένα άλλο άτομο υδρογόνου για να σχηματίσει το μόριο διατονικός. Θα διαφύγει ως αέριο υδρογόνο από το διάλυμα.
2Η+ + 2ε- = 2Η
2Η = Η2 (σολ)
Αυτή η ανταλλαγή ηλεκτρονίων μπορεί να υποστηρίξει τη λειτουργία μπαταριών αυτοκινήτου, οι οποίες αποτελούνται από ηλεκτρόδια μολύβδου Pb βυθισμένα σε διάλυμα θειικού οξέος Η2ΝΔ4.
Η ίδια ενέργεια λαμβάνεται σε όλους τους τύπους μπαταριών που διαχειρίζονται σε οικιακό επίπεδο: 9V, AA, AAA, D, για να αναφέρουμε μερικά παραδείγματα.
Ενέργεια τροφίμων
Τα ανθρώπινα όντα εξομοιώνουν την ενέργεια που απελευθερώνεται αποσυνθέτοντας την τροφή που τρώμε στο σώμα μας. Αυτή η ενέργεια είναι αυτό που χρησιμοποιεί το σώμα μας για μη συνειδητές λειτουργίες (πέψη, καρδιακός παλμός, κυτταρικές λειτουργίες) και εκείνες που πραγματοποιούμε.
Εφόσον δεν έχετε έντονη σωματική δραστηριότητα και ο μεταβολισμός σας είναι αργός, συνιστάται η τακτική πρόσληψη θερμίδων, επειδή τα τρόφιμα έχουν υψηλή περιεκτικότητα σε θερμίδες Τα σύνθετα λιπίδια και οι υδατάνθρακες, που έχουν πολύ μεγάλες δομές, είναι πιο δύσκολο να διαλυθούν, με αποτέλεσμα την αντιστροφή του Ενέργεια. Σε αυτήν την περίπτωση το αποτέλεσμα θα ήταν στιγμιαίο αντίθετο.
Συνιστάται να καταναλώνετε φρούτα όταν πρέπει να εργάζεστε τη νύχτα, επειδή ο καρπός περιέχει φρουκτόζη, έναν απλό υδατάνθρακα που είναι εύκολο να διαλυθεί και θα έχει διαθέσιμη ενέργεια μετά από εσάς κατανάλωση.
Χημική Ενέργεια και οι μετασχηματισμοί της
Θερμοηλεκτρικά φυτά
Τα βαρέα καύσιμα χρησιμοποιούνται σε θερμοηλεκτρικούς σταθμούς παραγωγής ενέργειας για υψηλή και θερμογόνο δύναμη μεγάλης διάρκειας. Γενικά είναι το καύσιμο πετρέλαιο (Fuel Oil). Η καύση, που είναι το χημικό στάδιο της διαδικασίας, θα χρησιμεύσει ως θερμαντικός παράγοντας για έναν λέβητα, ο οποίος θα παράγει κορεσμένο ατμό. Αυτός ο ατμός θα βγει υπό πίεση μέσω του δικτύου διανομής ατμού και θα αρχίσει να κινεί τις γεννήτριες τουρμπίνας. Αυτές οι συσκευές θα παράγουν ηλεκτρική ενέργεια για την παροχή του αντίστοιχου πληθυσμού.
Χημική Ενέργεια → Μηχανική Ενέργεια → Ηλεκτρική Ενέργεια
Λειτουργία αυτοκινήτων
Τα αυτοκίνητα εξαρτώνται από μια πηγή ισχύος, που είναι η μπαταρία. Στην μπαταρία, είναι ήδη γνωστό ότι συμβαίνει ηλεκτρολυτική αγωγιμότητα, η οποία τροφοδοτεί το σύστημα ανάφλεξης, τα εξαρτήματα ταμπλό και τις βοηθητικές πρίζες. Χάρη σε αυτή τη διαθέσιμη ηλεκτρική ενέργεια, το αυτοκίνητο θα μπορεί να κινηθεί για να μεταφέρει τον οδηγό στην επιθυμητή θέση.
Χημική Ενέργεια → Ηλεκτρική Ενέργεια → Μηχανική Ενέργεια

