50 Näited lahendustest
Miscellanea / / July 04, 2021
The lahendusi on üks tüüpi segud mis on olemas. Lahuse moodustavad komponendid ei reageeri keemiliselt, ehkki nende komponentide füüsikalisi omadusi saab muuta, kui need lahuse osaks saavad. Näiteks: suits, amalgaam, kohv piimaga.
Et segu oleks lahendus, peab see olema homogeenne Y ühtlanesee tähendab, et segatud komponente ei saa palja silmaga eristada ja et lisaks on lahustunud aine (aine, mida esineb vähem) ja lahusti (aine, mida ilmub suuremas koguses) jääb lahuses võetavas mahus ligikaudu muutumatuks. Soluudi osakaal lahuses või lahustis on see, mida nimetatakse "kontsentratsiooniks" ja tavaliselt võib sama lahuse valmistada soluudi erinevate kontsentratsioonide abil.
Lahused võivad moodustada ainete vahel, mis enne segamist on mis tahes erinevates ainetes liitmisseisundid. Lahendusi on praktiliselt kõigis liitmisseisundites. Üldiselt määratakse lahuse agregaatolek lahusti agregatsiooniseisundi järgi. Näiteks:
See on tavaline molekulide olemasolu lahustunud aine lahuses muudavad lahusti enda omadusi. Näiteks nende ühendite segamisel muutuvad kahe ühendi sulamis- ja keemistemperatuurid, samuti nende koostis.
tihedused ja värvid.Prantsuse teadlane Roult uuris lahenduste komponentide käitumist ja pakkus välja ka selle põhiseaduse (Roult's Law), mis ütleb, et ideaalse lahenduse ümbritseva aurusegu iga komponendi osaline aururõhk alates vedelikud see on võrdne iga puhta komponendi osarõhuga, korrutatuna selle mooliosaga lahuses. Ideaalseks lahenduseks peetakse lahendust, milles keemilised liigid on väga sarnased, seega ei arvestata nende omavaheliste vastasmõjude energia muutumist. Roulti seaduse põhivõrrand on:
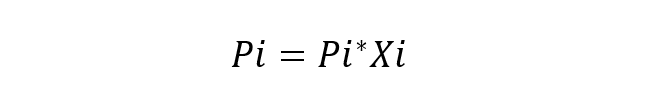
Kus:
- Pi on komponendi osaline rõhk i lahust ümbritsevas gaasilises segus.
- Pi * on komponendi rõhk i
- Xi on komponendi moolosa i lahustumisel.
Ilmselt puutuvad inimesed lahendustega püsivalt kokku. The õhk on elementide lahustumine gaasiline olek: selle enamuskoosseisu annab lämmastik (78%) ja ülejäänud osa hõivab 21% hapnik ja 1% muid komponente, kuigi need proportsioonid võivad veidi erineda.
Näited lahendustest
Järgmine loetelu sisaldab nelikümmend lahenduste näidet, rõhutades agregatsiooni olekut, milles igaüks neist on, lahustunud aine vastavas lahustis.
- Õhk (gaas gaasis). Gaaside koostis, kus lämmastikku on kõige rohkem.
- Suitsu (tahke gaasis). Õhk on tulest tuleva suitsu ilmnemise tõttu vananenud. See on lahus, milles õhk toimib lahustina.
- Sulamid metallide vahel (tahkis tahke). Duralumiinium on sulam, mis koosneb alumiiniumist, vasest, mangaanist, magneesiumist ja räni.
- Atmosfääri õhutolm (tahke gaasis). Tahkete ainete olemasolu (lagunenud peaaegu jagamatuks ühikuks, kuid lõpuks tahked ained) gaasis on selles mõttes lahustumise näide.
- Teras (tahkis tahke). Sulam raua ja süsiniku vahel, kusjuures esimese osakaal on palju suurem.
- Gaseeritud joogid (vedel gaas). Gaseeritud jookidel on gaasid lahustunud vedelikus.
- Amalgaam (vedel tahke aine). Need on teatud elavhõbedasulamid metallid nagu kuld või hõbe.
- Rafineeritud nafta (vedelik vedelas). Selle moodustavate elementide (enamus on süsinik) kombinatsioon põhjustab vedelike lahustumist.
- Butaan õhus (gaas gaasis). Butaan on a keemiline ühend gaasiline, mida saab hoida torudes, valmis kasutamiseks kütusena.
- Hapnik ookeanivees (vedel gaas). Merevee hapnikuga varustamine võimaldab arendada vee-elustikku.
- Alkoholisisaldusega joogid (vedelik vedelas). Inimesed tarbivad neid pidustustel väga. Need on tavaliselt etanooli ja puuviljamahlade lahused kontrollitud kontsentratsioonis alkohol.
- Kohv piimaga (vedelik vedelas). Kõrgema sisaldusega vedelik saab teiselt vähe, mis tähistab selle värvi ja maitse muutumist.
- Smog (gaasid gaasideks). Atmosfäärile mittetüüpiliste gaaside sisseviimine kutsub esile õhu muundumise, mis sellel on negatiivne mõju seda hingavatele ühiskondadele: mida kontsentreeritum, seda kahjulikum see on.
- Sool vees (tahke vedelikus). Kasutatakse laialdaselt toiduvalmistamiseks.
- Veri (vedelik vedelas). Enamik komponenti on plasma (vedelik) ja selle sees ilmnevad muud elemendid, mille hulgas punased verelibled eristuvad.
- Ammoniaak vees (vedelik vedelas). See lahendus (mida saab teha ka gaasist vedelaks) on toimiv paljudele puhastusvahenditele.
- Õhk niiskuse jälgedega (vedelik gaasis). Suurenemise tõttu on õhus veeauru temperatuur.
- Pulbrimahlad (tahke vedelikus). Pulber lahustub vees ja annab pulbrilise mahla värvi lahuse.
- Vesinik pallaadiumis (tahke gaas). Mõnedes metallides lahustub vesinik väga hästi.
- Õhus levivad viirused (tahke gaasis). Nagu atmosfääri tolm, on need ka väga väikesed tahke aine ühikud, mida transpordib gaas.
- Elavhõbe hõbedas (vedel tahke aine). See on üks nn "amalgaame".
- Tee (tahke vedelikus). Väga väikeste mõõtmetega tahke aine (ümbrise graniidid) lahustub vees.
- Kuninglik vesi (vedelik vedelas). See on kompositsioon happed mis võimaldab lahustada erinevaid metalle, mille hulgas esineb kulda.
- Pronks (tahkis tahke). See on vase ja tina sulam.
- Limonaad (vedelik vedelas. Ehkki segu on mitu korda tahke ja vedeliku vahel, on see tegelikult selles tahkises sisalduv vedelik, näiteks sidrunimahl.
- Peroksiid (vedelik vedelas). See on vesinikperoksiidi (H2VÕI2) vees. Seda kasutatakse haavade desinfitseerimiseks ja kosmeetikatööstuses.
- Messing (tahkis tahke). See on tahke vase ja tsingi sulam.
- Jää jahutamine (tahke vedelikus). Jää siseneb vedelikku ja jahutab seda, lahustudes. Kui see sisestatakse vette, on see konkreetne juhtum, kus see on sama aine.
- Füsioloogiline lahendus (vedelik vedelas). Vesi toimib lahustina ja paljud vedelad ained lahustuvana.
- Smuutid (tahked ained vedelikes). Jahvatusprotsessi kaudu indutseeritakse tahkete ainete ja vedelike kombinatsioon.
Järgige koos:



