20 Alkaanide näited
Miscellanea / / July 04, 2021
The alkaanid nad on omamoodi süsivesinikud milles muutuv arv süsinikuaatomeid on ühendatud üksiksidemetega, nagu luustik, ja iga süsinikuaatom on omakorda seotud vesiniku aatomitega, mis võib lõpuks asendada teistega aatomid või funktsionaalsed rühmad. Näiteks: kloroform, metaan, oktaan.
The molekulaarne valem avatud lineaarse ahelaga alkaanidest on CnH2n + 2, kus C tähistab süsinikku, H tähistab vesinikku ja n tähistab süsinikuaatomite arvu. Alkaanid on küllastunud süsivesinikud, mis tähendab, et neil pole topelt- ega kolmiksidemeid. Nende nimetamiseks kasutage järelliide "-Ano" pärast süsinikuahela nimetamist eesliide mis vastab süsinikuaatomite arvule (et- (2), pro- (3), but- (4), pen- (5), hex- (6), hep- (7) jne).
See võib teile teenida:
Alkaanide klassifikatsioon
Alkaanides tuntakse neid tavaliselt ära kaks suurt rühma: avatud ahel (nimetatakse ka atsükliliseks) ja suletud ahelaks (või tsükliliseks).
Kui avatud ahelaga ühendid Nad ei asenda iga süsinikuaatomiga kaasas olevaid vesinikke, neid nimetatakse lineaarseteks alkaanideks: need on kõige lihtsamad alkaanid. Kui nad on asendanud ükskõik millise oma vesiniku ühe või mitme süsinikuahelaga, nimetatakse neid hargnenud alkaanideks. Kõige tavalisemad asendajad on etüülrühmad (CH
3CH2-) ja metüül (CH3-).Teiselt poolt on molekulis ühe tsükliga ühendid (monotsüklilised) ja teised mitme (polütsüklilised). The tsüklilised alkaanid need võivad olla homotsüklilised (need moodustuvad ainult süsinikuaatomite sekkumisel) või heterotsüklilised (milles osalevad teised aatomid, näiteks hapnik või väävel).
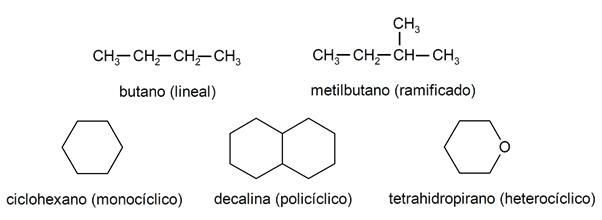
Alkaanide füüsikalised omadused
Üldiselt, füüsikalised omadused alkaanid tingitakse molekulmassiga (mis omakorda on seotud süsinikuahela pikkusega). Need, kus süsinike arv on kõige väiksem, on gaasiline kuni temperatuur keskkonnas on need vahemikus 5 kuni 18 süsinikuaatomit vedelikudja selle numbri kohal on tahke (sarnane vahaga).
Kuna vesi on vähem tihe, kipuvad nad sellel hõljuma. Üldiselt on alkaanid vees lahustumatud ja lahustuvad orgaanilistes lahustites.
Punkt keemine ja sulandumine alkaanide sisaldus sõltub nende sisaldusest molekulmass, see tähendab süsinikuahela pikkusest, kuigi need sõltuvad palju kordi ka aatomite ruumilisest paigutusest. Lineaarsetel ja tsüklilistel alkaanidel on kõrgemad keemistemperatuurid kui hargnenud.
Alkaanide keemilised omadused
Alkaane iseloomustab olemine keemilised ühendid väga halb reaktiivsus, mistõttu neid nimetatakse ka parafiinideks (ladina keeles parum affinis tähendab "madal afiinsus"). Need on ühendid, millel on väga suur aktivatsioonienergia, kui nad osalevad keemilised reaktsioonid. Kõige olulisem reaktsioon, mille alkaanid võivad läbi viia, on põlemine hapniku, soojuse, süsinikdioksiidi ja vee juuresolekul.
Alkaanid on aluseks olulistele mitmesugustele reaktsioonidele tööstusprotsessid väga oluline, olles kõige traditsioonilisem kütus. Need ilmuvad ka bioloogiliste protsesside, näiteks mõne poolt läbi viidud metanogeense kääritamise lõpptoodetena mikroorganismid.
Alkaanide näited
Mõned alkaanide näited (sealhulgas mõned tuntud lineaarsed ja hargnenud):
- Kloroform (väljamõeldud nimi triklorometaan; CHCl3). Selle aine aure kasutati varem anesteetikumidena. See on sel eesmärgil lõpetatud, kuna leiti, et see kahjustab elundid olulised, näiteks maks või neerud. Selle kasutamine on tänapäeval peamiselt lahusti või jahutusvedelikuna.
- Metaan (CH4). See on kõige lihtsam alkaan: see koosneb ainult ühest süsinikuaatomist ja neljast vesinikuaatomist. See on gaas, mis tekib looduslikult erinevate orgaaniliste substraatide lagunemisel ja on maagaasi põhikomponent. Viimasel ajal on seda tunnistatud üheks gaasiks, mis panustab kõige enam nn kasvuhooneefekti.
- Oktaan (C8H18). See on kaheksasüsinikeline alkaan ja sellel on suur tähtsus, kuna see määrab tööstusbensiini lõpliku kvaliteedi, mis on segada mitmesuguseid süsivesinikke. Seda kvaliteeti mõõdetakse kütuse oktaan- või oktaaniarvuga, mis võtab võrdluseks madala detoneeriva (indeks 100) ja väga detoneeriva (indeks 0).
- Heksaan (C6H14). See on oluline lahusti, selle sissehingamist tuleks vältida, kuna see on väga mürgine.
- Butaan (C4H10). Koos propaaniga (C3H8) moodustavad nn veeldatud naftagaasid (LPG), mis tekivad nafta ekstraheerimise käigus gaasikottides. Praegu propageeritakse bensiini või diislikütuse asendamist kütusena vedelgaasiga keskkonnasõbralikumast süsivesinikust (see eraldab põlemisel ainult süsinikdioksiidi ja vett).
- Icosano (C20H42). See on kahekümne süsinikuga alkaan (eesliide "ico" tähendab kakskümmend)
- Tsüklopropaan (C3H6). Varem kasutati seda anesteetikumina
- n-heptaan (C7H16). See on see, mida võetakse bensiini oktaanarvu skaala nullpunkti võrdlusalusena, mis oleks kõige vähem soovitav, kuna see põleb plahvatuslikult. See on saadud teatud vaigust taimed.
- 3-etüül-2,3-dimetüülpentaan (C9H20)
- 2-metüülbutaan (C5H12)
- 3-kloro-4-n-propüülheptaan (C10H21Cl)
- 3,4,6-trimetüülheptaan (C10H22)
- 1-bromo-2-fenüületaan (C8H9Br)
- 3-etüül-4-metüülheksaan (C9H18)
- 5-isopropüül-3-metüülnonaan (C13H28)
- Kuuba (C8H8)
- 1-bromopropaan (C3H7Br)
- 3-metüül-5-n-propüüloktaan (C12H26)
- 5-n-butüül-4,7-dietüüldekaan (C18H28)
- 3,3-dimetüüldekaan (C12H26)
