100 keemiliste elementide näidet
Miscellanea / / November 13, 2021
The keemilised elemendid on teatud tüüpi küsimus, mis ühegi protseduuri või keemiline reaktsioon neid saab taandada või lagundada muudeks lihtsamateks elementideks. Sel põhjusel võib öelda, et element on kõik asja valmistatud aatomid sama ja ainulaadse klassi, see tähendab aatomid, millel on sama aatomnumber (võrdne prootonite arv), ehkki neil on erinev aatomimass. Näiteks: väävel, boor, kroom, tina.
Keemilise elemendi esimese määratluse tutvustas Lavoisier aastal Traité Élémentaire de Chimie, 1789. aastal. Veel 18. sajandil jagas Lavoisier lihtsad ained nelja rühma:
Elementide perioodiline tabel
Täna tunnevad nad üksteist 118 keemilist elementi. Nad on kõik kokku pandud, klassifitseeritud ja korraldatud paljude omaduste järgi graafilises skeemis, mida nimetatakse elementide perioodilisustabeliks ja mille algselt lõi Vene keemik Dimitri Mendelejev aastal 1869. Perioodiline tabel koosneb 18 rühmast (veerud) ja 7 perioodist (rida), milles asuvad keemilised elemendid.
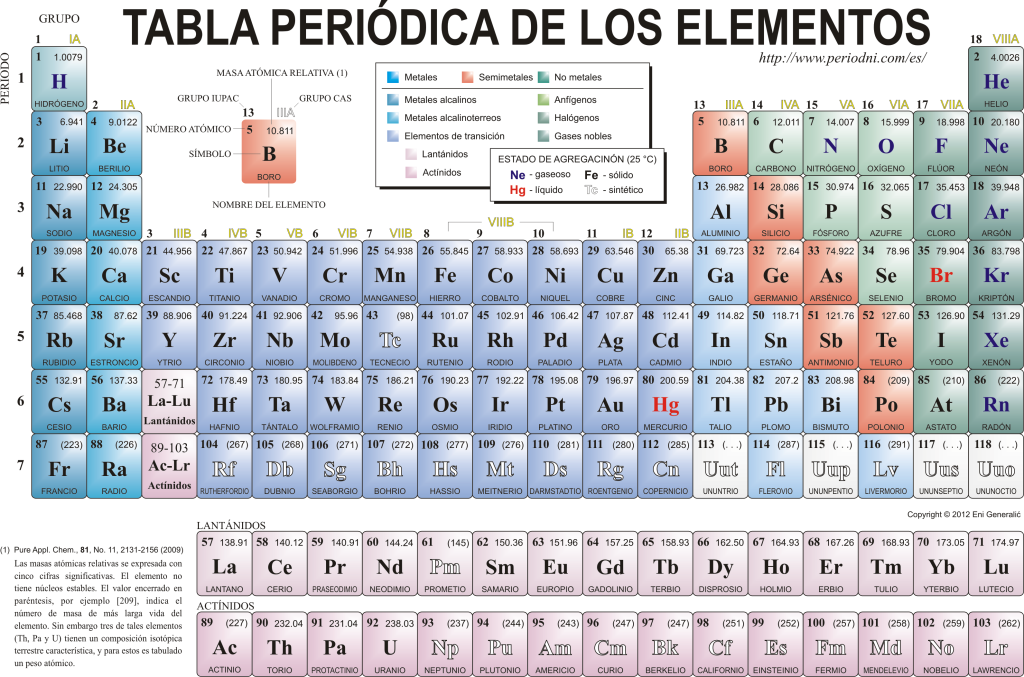
The peamised rühmad Sellest tabelist leiate:
Leelismetallid (rühm 1), leelismuldmetallid (rühm 2), skandiumiperekond, kuhu kuuluvad muldmetallid ja aktiiniidid (rühm 3), titaaniperekond (Rühm 4), vanaadiumi perekond (rühm 5), kroomi perekond (rühm 6), mangaaniperekond (rühm 7), raua perekond (rühm 8), koobalti perekond (rühm) 9), nikliperekond (rühm 10), vaskperekond (rühm 11), tsingiperekond (rühm 12), maaelemendid (rühm 13), karboniidelemendid on selles rühmas süsinik, mis moodustab elu Maal (rühm 14), lämmastikku moodustavad elemendid (rühm 15), amfigeneetilised elemendid, sisaldab hapnikku, mis on hingamine selle elusolendid (Rühm 16), halogeenelemendid (rühm 17) ja väärisgaasid (rühm 18).
Paljudel neist elementidest on stabiilsed või radioaktiivsed isotoopid, see tähendab, et samal keemilisel elemendil, näiteks vesinikul (H), võib olla mitu isotoopi (1H, 2H, 3H). See tähendab, et igal isotoobi aatomil on sama palju prootoneid (mis tähendab, et see kuulub samasse keemilisse elementi) ja erinevat arvu neutroneid.
Mõned isotoopid ei ole stabiilsed (radioaktiivsed), st lagunema teatud aja jooksul, eraldades teatud osakesi (muu hulgas neutroneid, footoneid, alfaosakesi) ja tekitades muid stabiilseid või radioaktiivseid isotoope. Keemilistel elementidel on sellised omadused nagu punkt keemine ja see sulandumine, elektronegatiivsus, tihedus ja ioonraadius. Need omadused on olulised, kuna võimaldavad ennustada selle käitumist, reaktsioonivõimet jne.
Kuidas on perioodilises tabelis toodud elemendid?
Iga keemilist elementi iseloomustab Perioodilisustabel kasutades teatud sümboloogiat. Esiteks, iga ruudu keskel selle universaalne sümbol, mis koosneb ühest või kahest tähed (kokkuleppeliselt, kui on kaks tähte, kirjutatakse esimene suurtähtedega ja järgmine väiketähtedega).
Ülal ja vasakul ilmub väike kirjatüüp su aatomnumber, mis näitab selle elemendi prootonite hulka. Elemendi sümboli all kuvatakse selle nimi ja ülal vasakul selle nimi. aatommass sugulane. Lisaks tähistab värv, milles elemendi sümbol on esindatud, selle liitmise olekut (vastavalt igas perioodilisustabelis kasutatavale kujutisele).
Erinevad elemendid aatomiraadius muutujad ja kui prootonite arv tuumas suureneb, seda suurem on atraktsioon, mida tuum elektronidele avaldab, seega kipub aatomi raadius vähenema. Kui aatomi raadius on väike, tõmbuvad pilve äärmisel tasemel olevad elektronid tuuma poole, nii et nad ei anna kergesti alla. Suure aatomraadiusega elementidega juhtub vastupidist: nad loobuvad oma välistest elektronidest kergesti.
Seega suureneb aatomiraadius perioodilisustabeli rühmade läbimisel ülevalt alla ja nende perioodide läbimisel väheneb vasakult paremale.
Keemiliste elementide näited
| Keemiline element | Sümbol |
| Aktiinium | Ac |
| Alumiinium | Et |
| Americium | OLEN |
| Antimon | Sb |
| Argoon | Ar |
| Arseen | Äss |
| Astat | Kell |
| Väävel | S |
| Baarium | Ba |
| Berüllium | Ole |
| Berkelium | Bk |
| Vismut | Bi |
| Bohrio | Bh |
| Boor | B |
| Broom | Br |
| Kaadmium | CD |
| Kaltsium | AC |
| Californium | Vrd |
| Süsinik | C |
| Tseerium | EÜ |
| Tseesium | Cs |
| Kloor | Cl |
| Koobalt | Co |
| Vask | Cu |
| Chrome | Kr |
| Kuurium | Cm |
| Darmstadio | Ds |
| Düsproosium | Kuule |
| Dubnium | Db |
| Einsteinium | see on |
| Erbium | Er |
| Skandium | Sc |
| Tina | Sn |
| Strontsium | härra |
| Europium | Eu |
| Fermium | Fm |
| Fluor | F |
| Matš | P |
| Francius | Fr |
| Gadoliinium | Gd |
| Gallium | Ga |
| Germaanium | Ge |
| Hafnium | Hf |
| Hassio | Hs |
| Heelium | mul on |
| Vesinik | H |
| Raud | Usk |
| Holmium | Ho |
| Indiaanlane | Sisse |
| Jood | Mina |
| Iridium | Minema |
| Ytterbium | Yb |
| Ütrium | Y |
| Krüpton | Kr |
| Lantaan | The |
| Lawrencio | Lr |
| Liitium | Li |
| Luteetium | Ee |
| Magneesium | Mg |
| Mangaan | Mn |
| Meitnerius | Mt |
| Mendelevium | Md |
| elavhõbe | Hg |
| Molübdeen | Mo |
| Neodüüm | Na |
| Neoon | Ne |
| Neptuunium | Np |
| Nioobium | Nb |
| Nikkel | Kumbagi |
| Lämmastik | N |
| Nobelio | Mitte |
| Kuld | Au |
| Osmium | Sina |
| Hapnik | VÕI |
| Pallaadium | P.S |
| Hõbe | Ag |
| Plaatina | Pt |
| Plii | Pb |
| Plutoonium | Pu |
| Poloonium | Po |
| Kaalium | K |
| Praseodüüm | Pr |
| Lubage | P.m |
| Protaktiinium | Pa |
| Raadio | Ra |
| Radoon | Rn |
| Reenium | Re |
| Roodium | Rh |
| Rubiidium | Rb |
| Ruteenium | Ru |
| Rutherfordio | Rf |
| Samaarium | Teie |
| Seaborgio | Sg |
| Seleen | Ma tean |
| Räni | Jah |
| Naatrium | Na |
| Tallium | Tl |
| Tantaal | Ta |
| Tehneetsium | Tc |
| Telluur | Tee |
| Terbium | Tb |
| Titaan | Sina |
| Toorium | Th |
| Tuulium | Tm |
| Kopernikus | Cn |
| Livermorio | Lv |
| Roentgenio | Rg |
| Ununoktium | Uuo |
| Ununpentium | Uup |
| Flerovio | Fl |
| Ununseptio | Uus |
| Ununtrium | Uut |
| Uraan | VÕI |
| Vanaadium | V |
| Volfram | W |
| Ksenoon | Xe |
| Tsink | Zn |
| Tsirkoonium | Zr |

Järgige koos: