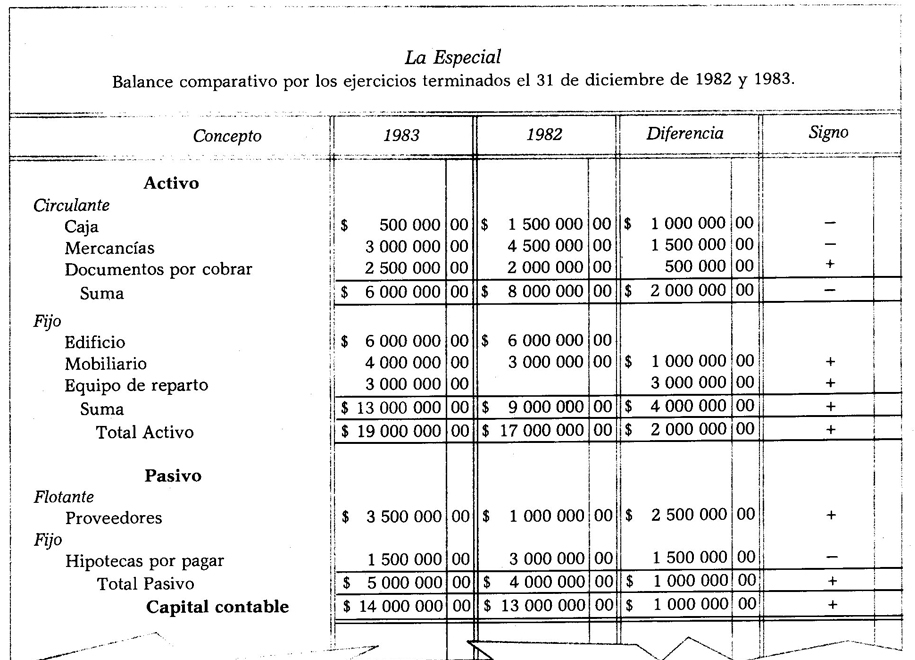
Mis on gaaside kineetiline teooria ja kuidas seda määratletakse?
Inhibeerimine Stringiteooria / / April 02, 2023

Keemiainsener
Gaasi kineetiline energia viitab iga selle osakese mahtuvusele, mis sõltub kiirusest ja seega ka temperatuurist, millele see allub. Selle kontseptsiooni alusel võimaldab gaasi difusioon liikuda läbi keskkonna.
Mõlemad mõisted, kineetiline energia ja difusioon gaasides, on käsitletud Molekulaarkineetiline teooria mille töötasid välja kaks teadlast (Boltzmann ja Maxwell) ja mis selgitab gaaside käitumist üldiselt.
Kineetilise energia funktsioon ja muutujad
Põhimõtteliselt kirjeldab Teooria muutujaid nagu osakeste kiirus ja kineetiline energia ning See seob need otseselt muude muutujatega, nagu rõhk ja temperatuur, mille juures gaas on Esita. Selle põhjal on võimalik kirjeldada järgmist:
\(P = \;\frac{{m\; \cdot \;{v^2} \cdot \;N}}{{3 \cdot V}}\)
See tähendab, et rõhk ja maht on seotud molekuli muutujatega (m ja N).
Ülaltoodule tuginedes pakuvad Maxwell ja Bolzmann välja matemaatilise funktsiooni, mis suudab kirjeldada gaasi kiiruste jaotust selle molaarmassi ja temperatuuri funktsioonina. Tuleb märkida, et see tulemus on saadud statistilise analüüsi põhjal, kus kõik gaasiosakesed ei oma sama kiirus, igaühel on oma kiirus ja jaotusest kõveral on võimalik leida kiiruse väärtus pool. Lõpuks öeldakse, et gaasi keskmine kiirus on:
\(v = \sqrt {\frac{{3\;R\;T}}{M}} \)
Kus kiirus sõltub absoluutsest temperatuurist (T), molaarmassist (M) ja universaalsest gaasikonstandist (R).
Siis saab tõlgendada, et kui erinevad gaasid on samal temperatuuril, on suurema molaarmassiga gaasi keskmine kiirus väiksem ja vastupidi. Samamoodi, kui sama gaas puutub kokku kahe erineva temperatuuriga, on sellel, kus temperatuur on kõrgem, suurem keskmine kiirus, nagu on oodata.
Kiiruse mõiste on tihedalt seotud gaasi kineetilise energiaga, kuna:
\(Ec = \frac{1}{2}m{v^2}\)
Osakese energia on selle keskmise kiiruse funktsioon. Nüüd on gaasi puhul molekulaarkineetilise teooria kohaselt teada, et keskmine väärtus saadakse järgmiselt:
\(\overline {Ec} = \;\frac{{3\;R\;T}}{2}\)
Ja see sõltub ainult temperatuurist.
difusioon gaasides
Kui me räägime gaasidest, siis nende defineerimiseks võib mainida erinevaid omadusi. Näiteks võime rääkida nii selle tihedusest, viskoossusest, aururõhust kui ka paljudest muudest muutujatest. Üks neist (ja väga oluline) on levitamine.
Difusioon on seotud nende võimega teatud keskkonnas liikuda. Üldiselt on difusioon seotud "liikuvate jõududega", mis võimaldavad vedeliku migratsiooni ühelt küljelt teisele. Näiteks gaasi difusioon sõltub paljudest parameetritest, näiteks sellest, kas punktide A ja B vahel, mille poole see liigub, on rõhkude erinevus või kontsentratsioonide erinevus. See omakorda sõltub ka sellistest teguritest nagu temperatuur ja gaasi molaarmass, nagu eespool näha.
Ülaltoodu põhjal uuris Graham gaaside käitumist nende difusiooni seisukohalt ja jäljendas seadust, mis sätestab, et:
"Konstantsel rõhul ja temperatuuril on erinevate gaaside difusioonikiirused pöördvõrdelised nende tiheduse ruutjuurega." Matemaatilises mõttes väljendatakse seda järgmiselt:
\(\frac{{{v_1}}}{{{v_2}}} = \;\sqrt {\frac{{{\rho _2}}}{{{\rho _1}}}} \)
Olles v1 ja v2, on gaaside kiirused ja \(\rho \) nende tihedused.
Kui töötame matemaatiliselt eelmise avaldisega, saame:
\(\frac{{{v_1}}}{{{v_2}}} = \;\sqrt {\frac{{{M_2}}}{{{M_1}}}} \)
Kuna M1 ja M2 on vastavalt molaarmassid ja kui rõhk ja temperatuur ei muutu, on nende vaheline seos identne gaaside tiheduste vahelise suhtega.
Lõpuks väljendab Grahami seadus ülaltoodut difusiooniaja kaudu. Kui arvestada, et mõlemad gaasid peavad difundeeruma sama pikkusega ja eelnevalt määratud kiirustel v1 ja v2, võib öelda, et:
\(\frac{{{t_1}}}{{{t_2}}} = \;\sqrt {\frac{{{M_2}}}{{{M_1}}}} \)
Lõpuks võime järeldada, et suurema molaarmassiga gaasil on pikem difusiooniaeg kui väiksema molaarmassiga gaasil, kui mõlemal on samad temperatuuri- ja rõhutingimused.