50 näidet aldehüüdidest ja ketoonidest
Näiteid / / November 06, 2023
The aldehüüdid on orgaanilised ühendid mille struktuuris on karbonüüli funktsionaalrühm (= C = O), mis on seotud süsinikuahela ja vesinikuaatomiga. Näiteks: metanaal (nimetatakse ka formaldehüüdiks), etanaal (nimetatakse ka atseetaldehüüdiks) ja propanaal (nimetatakse ka propaldehüüdiks).
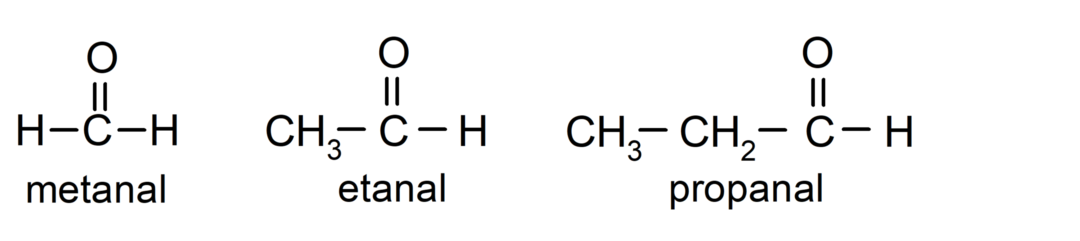
The ketoonid Need on orgaanilised ühendid, mille struktuuris on karbonüülrühm, mis on seotud kahe süsinikuaatomiga. Näiteks: propanoon (nimetatakse ka atsetooniks), butanoon ja 2-pentanoon.
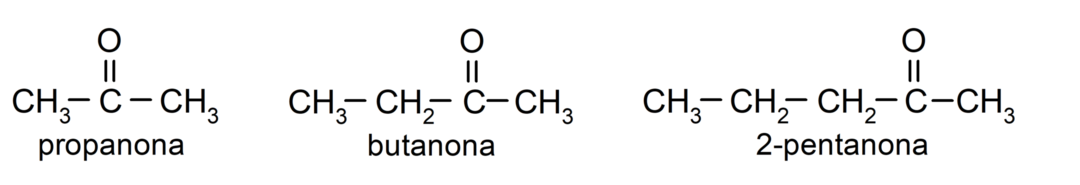
Aldehüüdide ja ketoonide erinevus
Peamised erinevused aldehüüdide ja ketoonide vahel on järgmised:
- Aldehüüdide struktuuris on karbonüül-funktsionaalne rühm, mis asub ühes otsas, samas kui ketoonidel on karbonüülrühm nende mitteterminaalsetes positsioonides struktuur.
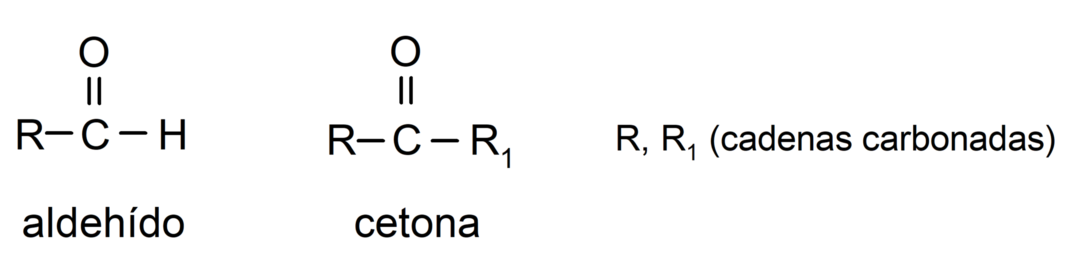
- Aldehüüdid oksüdeeritakse reaktsioonil Tollensi reagendiga, moodustades metallilise hõbeda. Need oksüdeeruvad ka Benedicti reagendi vastu, moodustades vaskoksiidi. Kumbki reagent ei oksüdeeri ketoone.
- Aldehüüdid redutseeritakse primaarseteks alkoholideks, ketoonid aga sekundaarseteks alkoholideks.
Füüsikalised omadused
Aldehüüdide füüsikalised omadused
Aldehüüdide füüsikalised omadused on väga mitmekesised, kuna need sõltuvad karbonüülrühmaga seotud süsinikahela koostisest.
Mõned on:
- Vees kõige paremini lahustuvad aldehüüdid on väiksema suurusega, näiteks metanaal ja etanaal.
- Lenduvatel aldehüüdidel on terav ja isegi ärritav lõhn.
- Karbonüülrühm annab neile polaarsuse.
- Nende keemistemperatuur on tavaliselt kõrgem kui sarnase molekuli suurusega keemilistel ühenditel.
Ketoonide füüsikalised omadused
Ketoonide füüsikalised omadused sõltuvad sellest, kuidas moodustub karbonüülrühmaga seotud süsinikahel.
- Paljudel ketoonidel on meeldiv lõhn.
- Selle lahustuvus vees sõltub karbonüülrühmaga seotud süsinikuahela suurusest. Mida väiksem on süsinikuahel, seda lahustuvam on ketoon vees.
- Karbonüülrühm annab neile märgatava polaarsuse.
- Võrreldes molekulaarse suurusega keemiliste ühenditega, on neil üsna kõrge keemistemperatuur.
Keemilised omadused
Aldehüüdide keemilised omadused
Aldehüüdide keemiliste omaduste hulgast leiame:
Need oksüdeeritakse, moodustades vastava karboksüülhappe, see tähendab, et moodustunud happel on süsinikuahelas sama arv süsinikke kui aldehüüd mis selle põhjustas. Näiteks:
- Oksüdeerimine Tollensi reagendiga (ammooniumhõbeda kompleks aluselises lahuses, [Ag (NH)3)2]+) toodab etanaalist etaanhapet ja metallist hõbedat.
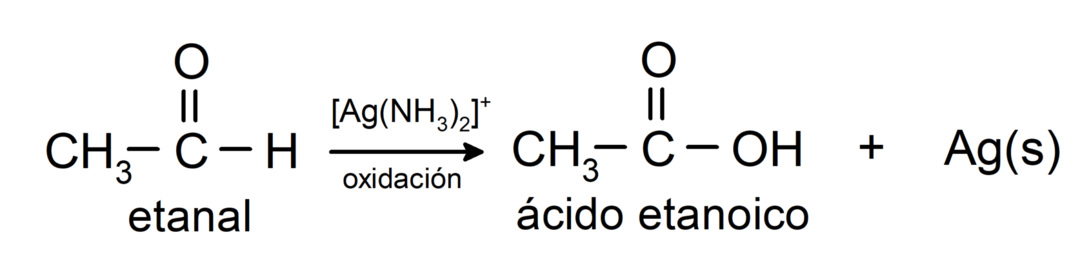
- Etanaali oksüdeerimine Benedicti reagendiga (vasksulfaadi leeliseline lahus) tekitab etaanhapet ja vaskoksiidi.
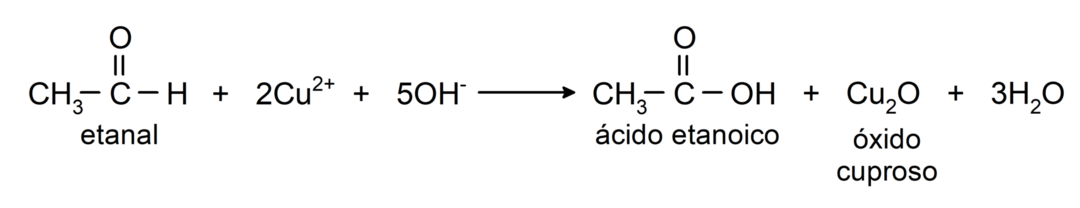
Nad läbivad nukleofiilseid liitumisreaktsioonest nukleofiili lisamine karbonüülrühma. Näiteks:
- Vesiniktsüaniidhappe lisamine tsüanohüdriinide või tsüanohüdriinide moodustamiseks.
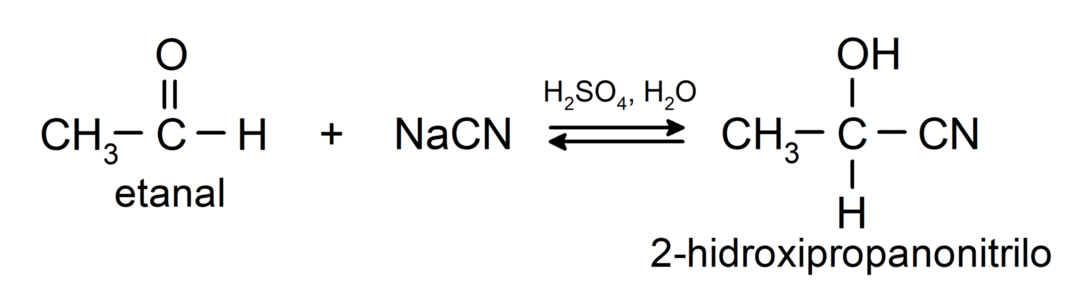
- Veevabade hapete juuresolekul lisatakse aldehüüdide karbonüülrühma alkoholid, moodustades atsetaalid ja poolatsetaalid.
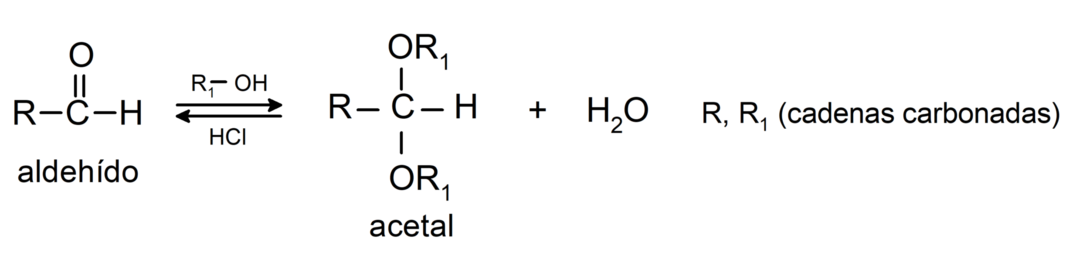
Nad läbivad aldooli kondensatsioonireaktsiooni. Nendes reaktsioonides toimub kahe aldehüüdi ühinemine naatriumhüdroksiidi (NaOH) ja keemiline ühend saadud tulemust nimetatakse aldooliks. Näiteks:
- Etanaali kondensatsioonireaktsioon lahjendatud NaOH juuresolekul.
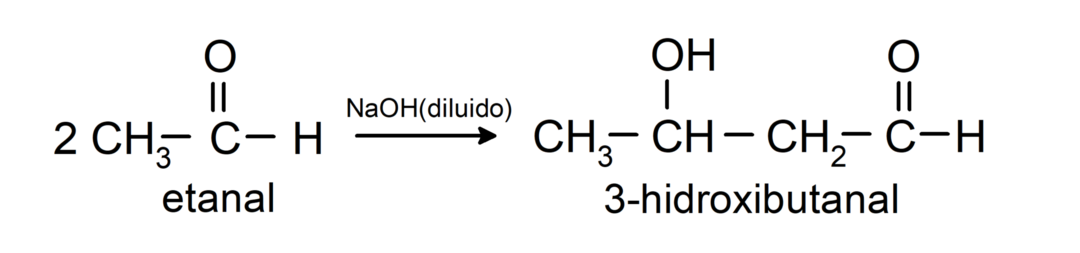
Need redutseeritakse primaarseteks alkoholideks. Aldehüüde saab redutseerida primaarseteks alkoholideks katalüütilise hüdrogeenimise või naatriumboorhüdriidiga (NaBH) redutseerimise teel.4) ja liitiumalumiiniumhüdriid (LiAlH4).
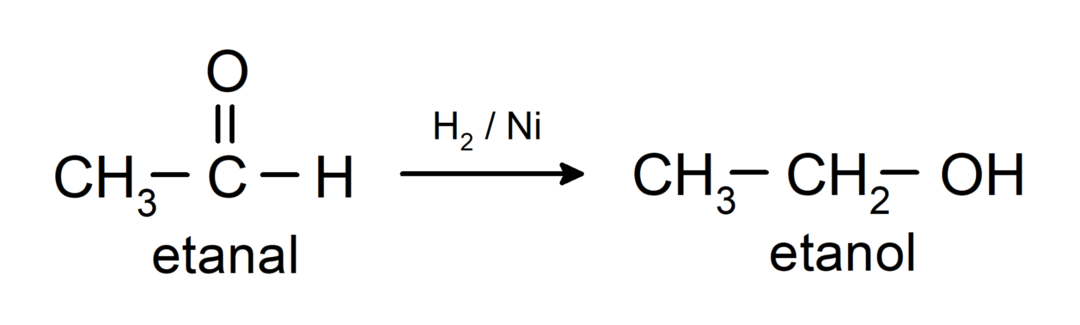
Ketoonide keemilised omadused
Ketoonide keemiliste omaduste hulgast leiame:
Nad läbivad nukleofiilseid liitumisreaktsioone. Näiteks:
- Vesiniktsüaniidhappe lisamine tsüanohüdriinide või tsüanohüdriinide moodustamiseks.
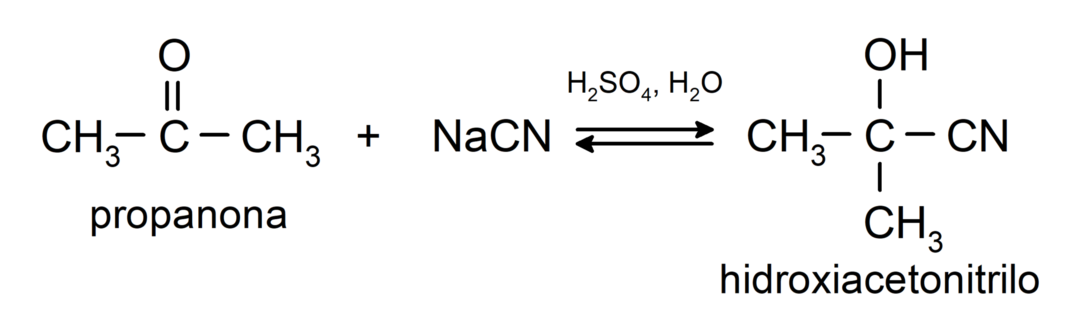
Nad lisavad alkoholi (veevabade hapete juuresolekul) ketoonide karbonüülrühmaks, moodustades ketaalid ja hemiketaalid. Näiteks:
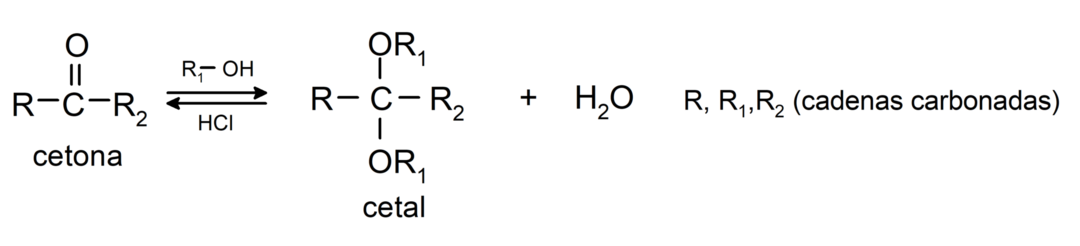
Nad läbivad halogeenimisreaktsioone. Ketoonid, millel on alfa-vesinik (α) reageerivad, asendades selle vesiniku halogeenidega (kloor (Cl), broom (Br), jood (I), fluor (F)) happeliste või aluseliste katalüsaatorite juuresolekul. Asendamine toimub peaaegu eranditult süsinikuga αst süsinik, mis on vesinikuga seotud α. Näiteks:
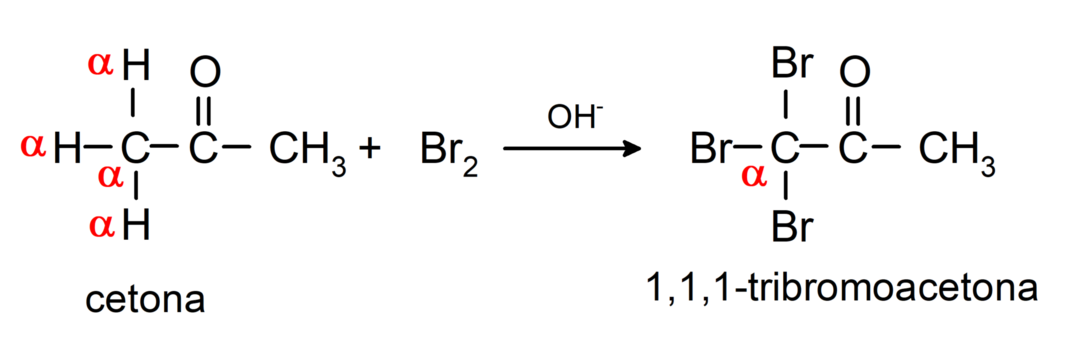
Need redutseeritakse sekundaarseteks alkoholideks katalüütilise hüdrogeenimise või naatriumboorhüdriidiga (NaBH) redutseerimise teel4) ja liitiumalumiiniumhüdriid (LiAlH4). Näiteks:
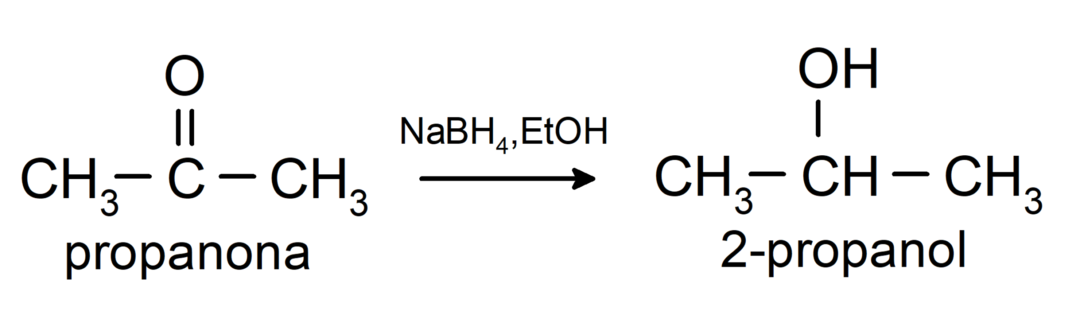
Tollensi ja Benedicti reaktiivid ei oksüdeeri ketoone.
Aldehüüdide nomenklatuur
Vastavalt Rahvusvahelise Puhta ja Rakenduskeemia Liidu (IUPAC) kehtestatud reeglitele, Aldehüüdid nimetatakse eesliidetega, mis näitavad süsiniku arvu ahelas. gaseeritud. Karbonüülrühma asukohta pole vaja täpsustada, kuna see on alati molekuli ühes otsas positsioonis üks. Lisaks kirjutatakse aldehüüdi nime lõppu järelliide -al. Näiteks:
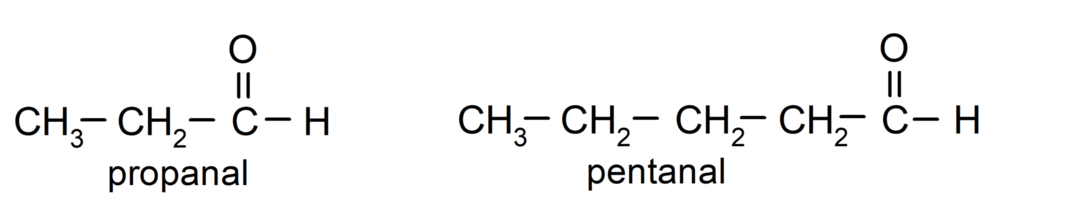
Kui aldehüüd koosneb mitmest süsinikuahelast, see tähendab, et sellel on harud, valitakse peaahelaks suurima süsinikuaatomite arvuga süsinikuahel. Ülejäänud ahelaid nimetatakse asendusrühmadeks ja iga asendaja asend valitakse nii, et see hõivaks ahelas võimalikult väikese arvu. Lisaks hakatakse süsinikuaatomeid lugema alates otsast, kus on karbonüülrühm. Näiteks:
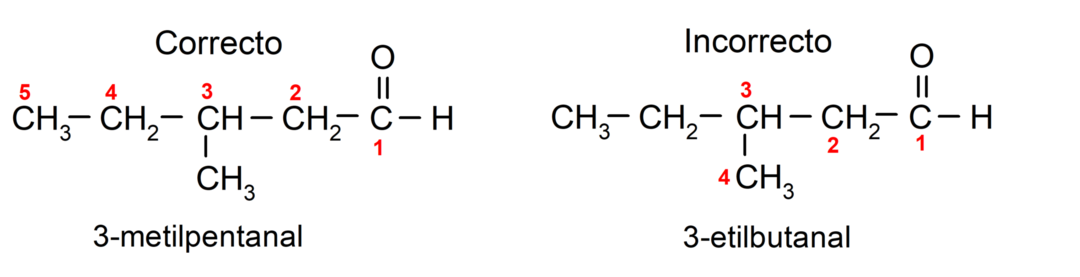
Aldehüüde, millel on kaks karbonüülrühma, nimetatakse sufiksiga -dial. Näiteks:
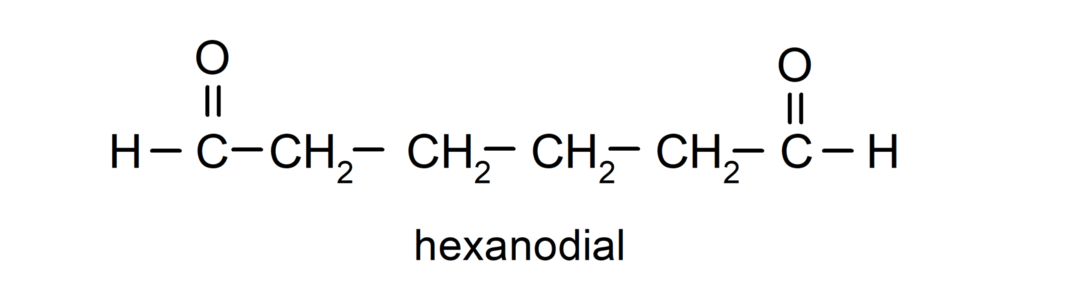
Ketoonide nomenklatuur
Rahvusvahelise puhta ja rakenduskeemia liidu (IUPAC) andmetel nimetatakse ketoonideks eesliiteid, mis näitavad süsinikuahelas olevate süsinike arvu.
Teisest küljest kirjutatakse atsetooni nimi, kasutades järelliidet -one, millele eelneb number, mis näitab karbonüülrühma asukohta süsinikuahelas. Karbonüülrühma asukoht tuleks valida nii, et see vastaks võimalikult väikesele numeratsioonile. Näiteks:
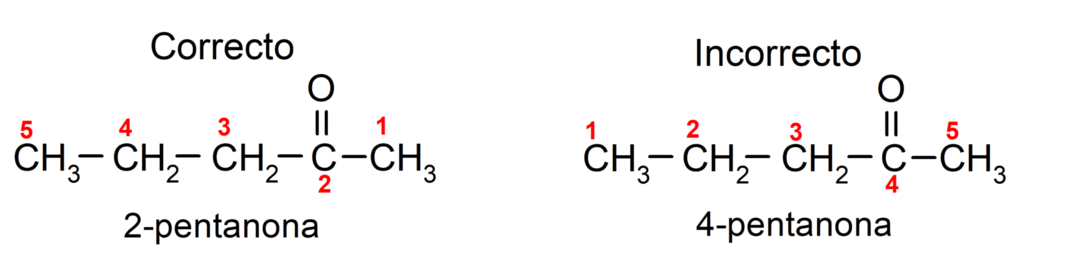
Et nimetada ketooni, mis koosneb mitmest süsinikuahelast, see tähendab harudest, valime peaahelana suurima süsinikuaatomite arvuga süsinikuahel, mis sisaldab rühma karbonüül. Ülejäänud ahelaid nimetatakse asendusrühmadeks. Näiteks:
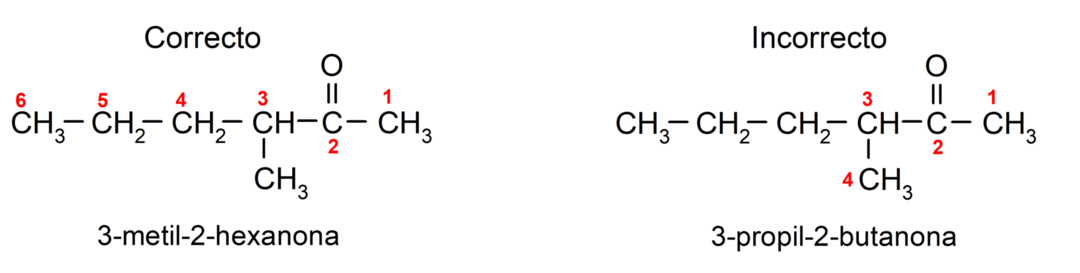
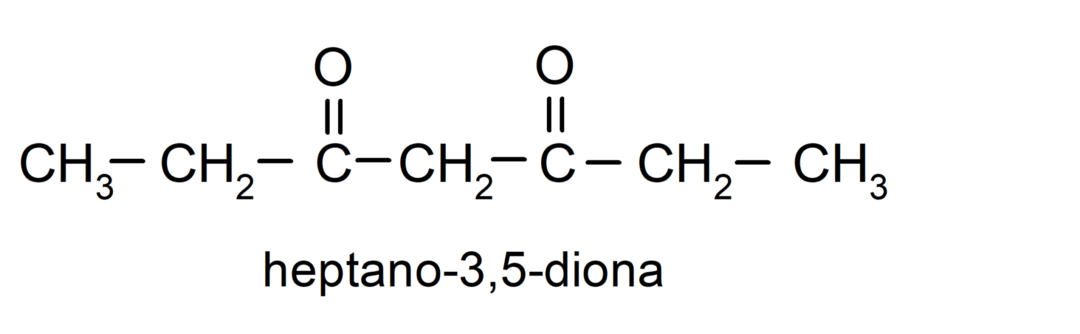
On ketoone, millel on kaks karbonüülrühma, neid nimetatakse dioonideks. Näiteks:
Aldehüüdide näited
- metanaal (formaldehüüd)
- etanaal (atsetaldehüüd)
- propanaal (propaldehüüd)
- butanaal
- pentanal
- heksaanaal
- 3-bromotsüklopentaankarbaldehüüd
- tsükloheksaankarbaldehüüd
- bensaldehüüd
- 4,4-dimetüülpentanaal
- 2-hüdroksübutanaal
- 2-hüdroksü-2-metüülbutanaal
- 2,3-dimetüülpentanaal
- pentaaniaal
- 4-hüdroksü-3-metoksübensaldehüüd
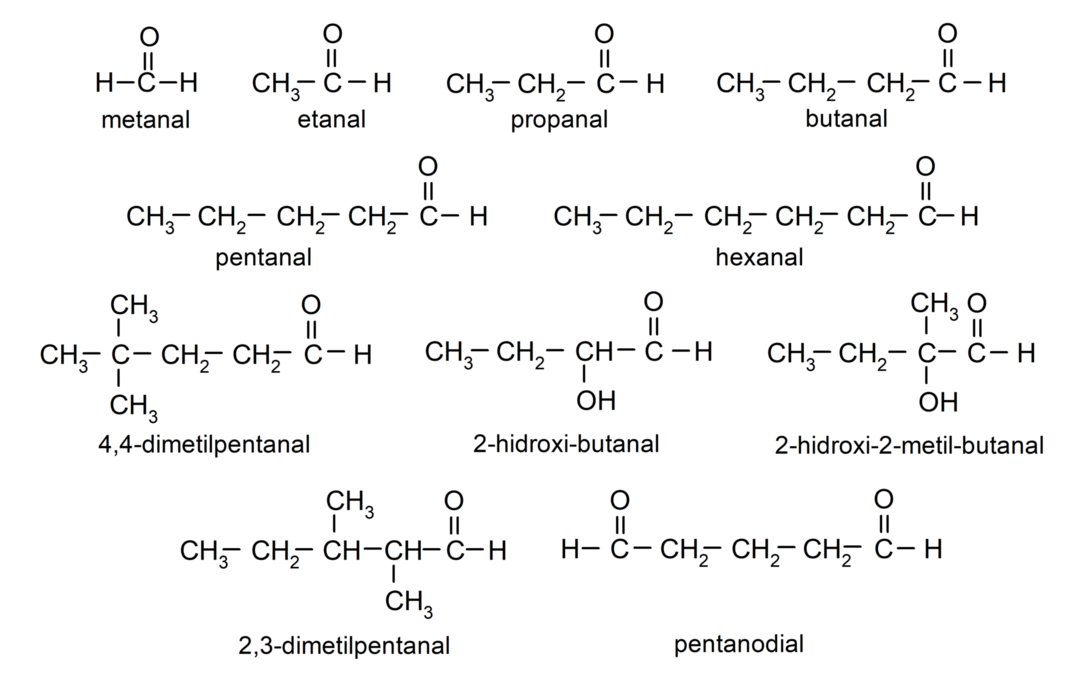
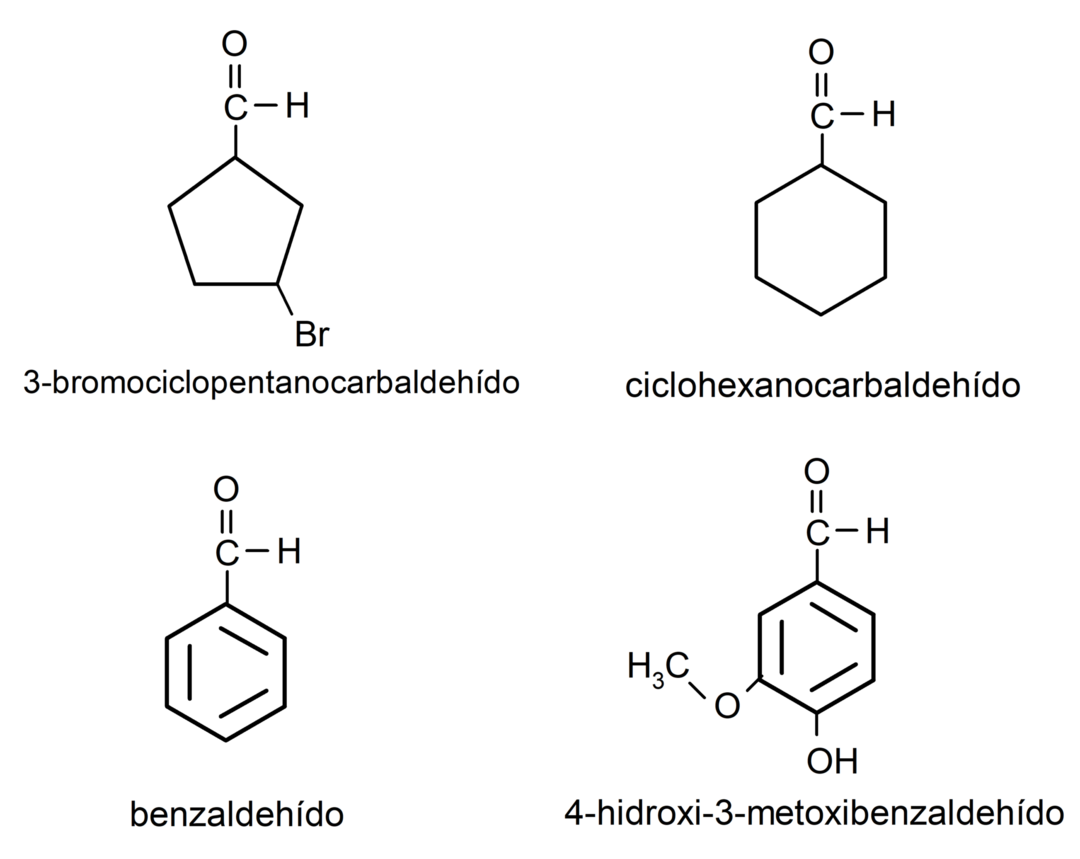
Näited ketoonidest
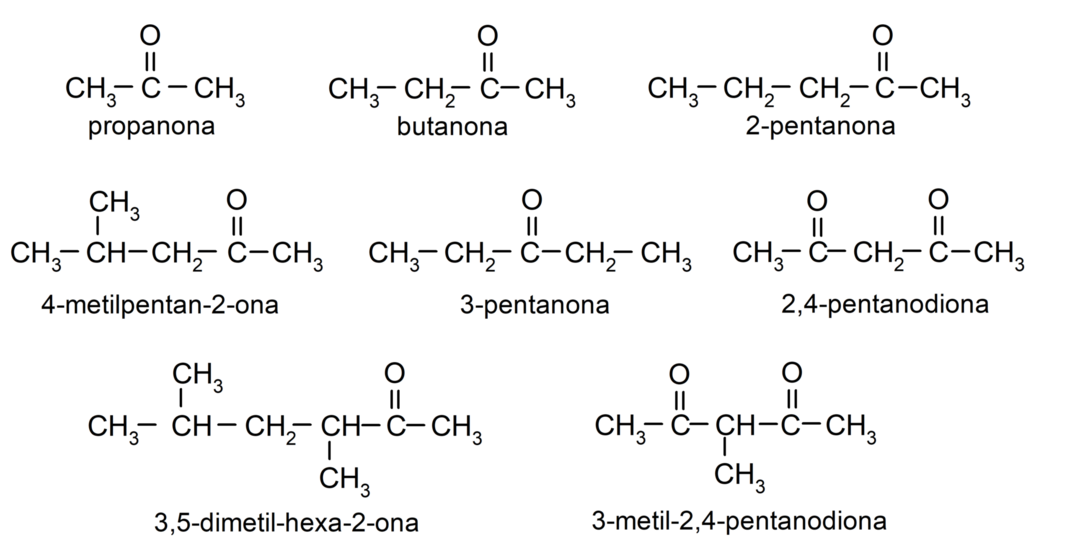
- propanoon (atsetoon)
- butanoon
- 2-pentanoon
- 4-metüülpentaan-2-oon
- 3-metüültsükloheksanoon
- tsükloheksüülmetüülketoon
- 3,4-dimetüülheksaan-2-oon
- etüülfenüülketoon
- 2,4-pentaandioon
- tsükloheksanoon
- 3-pentanoon
- 3-metüül-2,4-pentaandioon
- 1-fenüülpropanoon
- tsüklopentanoon
- difenüülketoon
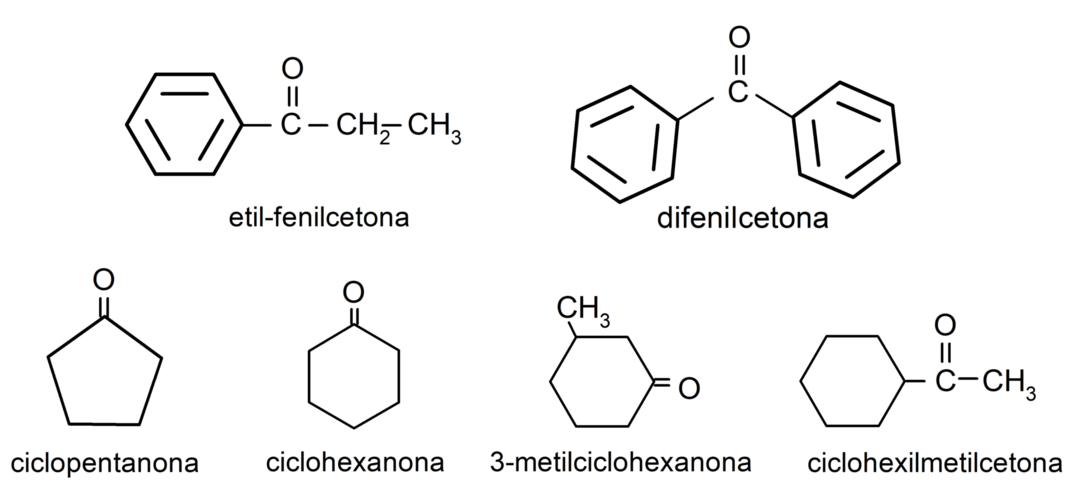
Aldehüüdide kasutamine igapäevaelus
Mõned aldehüüdide kasutusalad on järgmised:
- Neid kasutatakse lahustite, värvide, parfüümide, vaikude ja essentside tootmiseks.
- Neid kasutatakse säilitusainetena kosmeetikatoodetes, bioloogilistes proovides ja surnukehades. Nendel eesmärkidel kasutatakse enim formaldehüüdi.
- Neid kasutatakse plastide tootmiseks, mis võimaldavad autotööstuses metallosi vahetada.
- Neid kasutatakse mõne toidu maitseainetena.
- Neid kasutatakse desinfektsioonivahenditena.
- Neid on kasutatud teatud lõhkeainete, näiteks pentaerütritooltetranitraadi (TNPE) valmistamiseks.
Ketoonide kasutamine igapäevaelus
Mõned ketoonide kasutusalad on järgmised:
- Neid kasutatakse lahustite tootmisel. Eriti laialdaselt kasutatakse atsetooni värvide ja lakkide eemaldamiseks.
- Neid kasutatakse mõnede kummide ja määrdeainete valmistamisel.
- Neid kasutatakse värvide, lakkide ja lakkide tootmiseks.
- Neid kasutatakse ravimite ja kosmeetikatoodete tootmiseks.
Aldehüüdi ja ketooni toksilisus
- Aldehüüdid. Kokkupuude aldehüüdidega põhjustab naha, silmade ja hingamisteede ärritust. Lisaks on aldehüüdidega kokkupuudet seostatud selliste haigustega nagu vähk, kontaktdermatiit ning maksa- ja neurodegeneratiivsed haigused. Näiteks formaldehüüdi peab WHO (Maailma Terviseorganisatsioon) kantserogeenseks ühendiks.
- ketoonid. Korduv kokkupuude ketoonidega võib kahjustada kesknärvisüsteemi. See võib põhjustada mälukaotust, nõrkust, lihasvalusid ja krampe. Lisaks, kui nahk puutub kokku ketoonidega, tekib kuivus ja praod. Teisest küljest, kui ketoonid sisse hingata, tekib hingamisteede ärritus ja köha.
Viited
- Llorens Molina, JA. (2018). “Aldehüüdid ja ketoonid: mõned näited.” http://hdl.handle.net/
- Gabriel Pinto Cañón, Manuela Martín Sánchez, José María Hernández Hernández, María Teresa Martín Sánchez (2015) “Tollensi reaktiiv: aldehüüdide tuvastamisest kuni nende kasutamiseni nanotehnoloogias. Ajaloolised aspektid ja didaktilised rakendused.”Vol. 111 nr. 3. Hispaania kuninglik keemiaühing.
- William Bauer, Jr. (2000) «Metakrüülhape ja selle derivaadid» Ullmann’s Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. DOI: 10.1002/14356007.a16_441.
- "Nad paljastavad uue toksilisuse mehhanismi kantserogeensete ühendite rühmas, mis on saadud dieedist ja keskkonnast" (2022) www.conicet.gov.ar Saadaval: https://www.conicet.gov.ar/ Kasutatud: 20. juunil 2023.
Järgige:
- Alkoholid
- Suhkrud
- Alkaanid
