30 Aldehüüdide näiteid
Näiteid / / November 06, 2023
The aldehüüdid on orgaanilised ühendid mis on moodustatud süsinikahelast, millel on otsmine karbonüülrühm (= C = O) (asub ahela ühes otsas). molekul), mis omakorda on seotud vesinikuaatomiga.
Väga levinud aldehüüdid on metanaal (formaldehüüd), etanaal (atsetaldehüüd) ja propanaal (propaldehüüd).

Mõned neist ühenditest on looduses olemas, näiteks vanilliin või vanilliin on looduslik aldehüüd, mis on vanilje peamine maitseaine.
- Vaata ka: Aldehüüdid ja ketoonid
Aldehüüdide nomenklatuur
Aldehüüde saab nimetada Rahvusvahelise Puhta ja Rakenduskeemia Liidu (IUPAC) kehtestatud nomenklatuurireeglite järgi.
Aldehüüdi nimetamiseks kasutatakse eesliiteid, mis näitavad süsinikuaatomite arvu, mille süsinikahel on karbonüülrühmaga seotud. Karbonüülrühm asub alati süsinikuahela ühes otsas, mis tähendab, et sellel on alati positsioon üks ja selle asukohta ahelas pole vaja näidata. Lisaks asetatakse aldehüüdi nime lõppu järelliide -al. Mõned näited on järgmised:
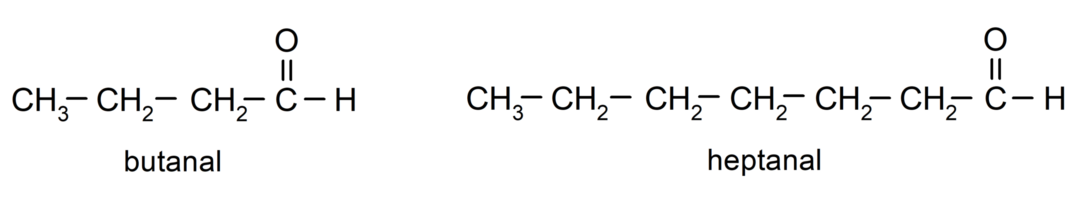
Kui aldehüüd on hargnenud, see tähendab, et see koosneb mitmest süsinikuahelast peaahel kui ahel, milles on kõige rohkem süsinikuaatomeid ja mis sisaldab ka rühma karbonüül. Ülejäänud ahelaid nimetatakse asendusrühmadeks.
Lisaks tuleb iga asendusrühm valida nii, et selle positsioon oleks põhisüsiniku ahelas võimalikult madalal arvul. Teisest küljest hakatakse peaahela süsinikuaatomeid lugema lõpus, mis sisaldab karbonüülrühma. Mõned näited on järgmised:
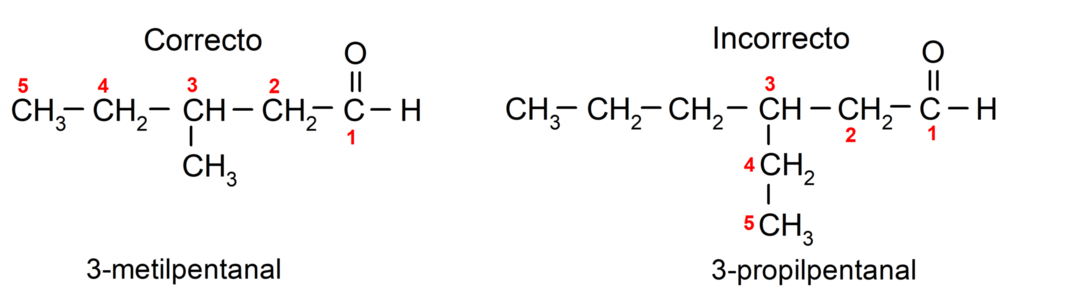
Kui aldehüüd toimib molekulis asendajana, kuna see koosneb ka rühmadest kõrgema prioriteediga funktsionaalrühmad, nagu happed ja estrid, siis nimetatakse aldehüüdrühma kui -okso. Näiteks:

Kui aldehüüdil on mitu karbonüülrühma, nimetatakse selle nimeks eesliited, mis näitavad nende rühmade arvu, dial (kaks karbonüülrühma), trial (kolm karbonüülrühma) jne. Näiteks:
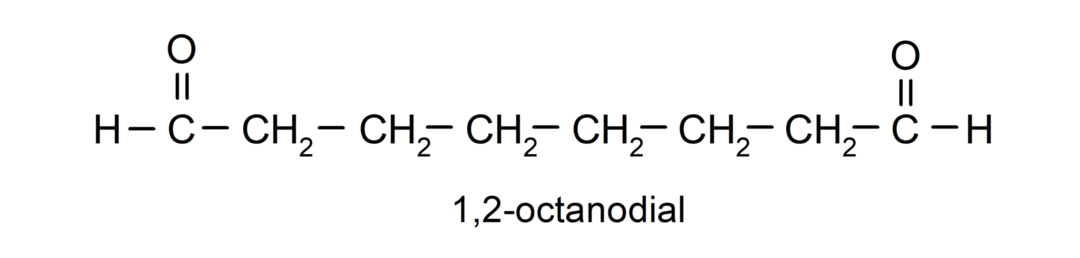
Kui karbonüülrühm on tsükliga seotud, nimetatakse aldehüüde terminiga karbaldehüüd. Näiteks:

Aldehüüdide füüsikalised omadused
Aldehüüdidel on tavaliselt sama füüsikaline omadus. See juhtub seetõttu, et aldehüüdide füüsikalised omadused sõltuvad sellest, kuidas moodustub karbonüülrühmaga seotud süsinikahel.
Mõned aldehüüdide füüsikalised omadused on järgmised:
- Lahustuvus. Aldehüüdide lahustuvus vees sõltub nende kogusest aatomid millel on süsinikuahel. Lühemate süsinikuahelatega (kuni umbes viie süsinikuaatomiga) aldehüüdid lahustuvad vees. Paljude süsinikuaatomitega süsinikuahelatega aldehüüdid ei lahustu vees. Metanaal ja etanaal lahustuvad vees väga hästi.
- Tihedus. Üldiselt on aldehüüdid ühendid, mis on vähem tihedad kui vesi.
- Koondamisriigid. Aldehüüdid, mis koosnevad ühest ja kahest süsinikuaatomist, on gaasid, on need, mis sisaldavad kolm kuni kaksteist süsinikuaatomit vedelikudja need, mis koosnevad enam kui kaheteistkümnest süsinikuaatomist, on tahked.
- Lõhn. Mõnel aldehüüdil on ärritav lõhn, teistel aga meeldiv lõhn.
- Polaarsus. Karbonüülrühm annab neile polaarsuse.
- Keemispunkt. Nende keemistemperatuur on kõrgem kui sarnase molekulmassiga alkaanidel ja madalam keemistemperatuur kui võrreldava molekulmassiga karboksüülhapetel ja alkoholidel.
Aldehüüdide keemilised omadused
Mõned aldehüüdide keemilised omadused on järgmised:
Aldehüüdid oksüdeeritakse, kui nad reageerivad Tollensi, Benedicti ja Fehlingi reaktiividega. et moodustada vastav karboksüülhape. Moodustunud happe süsinikuahelas on sama arv süsinikke kui aldehüüdil, millest see moodustati. Näiteks:
- Oksüdeerimine Tollensi reagendiga (ammooniumhõbeda kompleks aluselises lahuses, [Ag (NH)3)2]+). See reaktsioon tekitab vastava happe ja metallilise hõbeda.

- Oksüdeerimine Benedicti ja Fehlingi reagendiga (vask(II)sulfaadi (CuSO) aluselised lahused4) erinevate koostistega). See reaktsioon tekitab vastava happe ja vaskoksiidi (Cu2KAS).

Nad läbivad nukleofiilseid liitumisreaktsioone, kus aldehüüdide karbonüülrühma lisatakse nukleofiilid. Mõned näited on järgmised:
- liitumisreaktsioonid alkoholid aldehüüdide karbonüülrühma, moodustades atsetaalid ja poolatsetaalid.
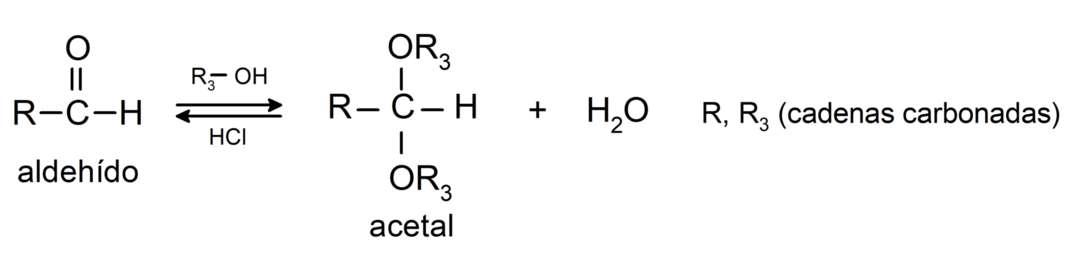
- liitumisreaktsioonid amiinid esmane karbonüülrühma suhtes.

- Vesiniktsüaniidhappe (HCN) liitumisreaktsioonid, kus tekivad tsüanohüdriinid või tsüanohüdriinid.

Nad läbivad aldooli kondensatsioonireaktsiooni. Seda tüüpi reaktsioonis kondenseeruvad kaks aldehüüdi, moodustades aldooli. Need on reaktsioonid, mis toimuvad naatriumhüdroksiidiga (NaOH). Näiteks:
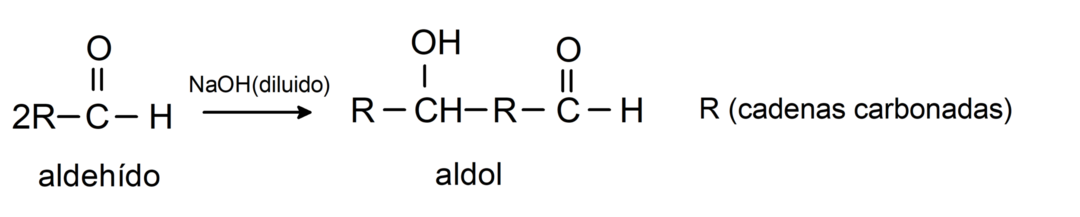
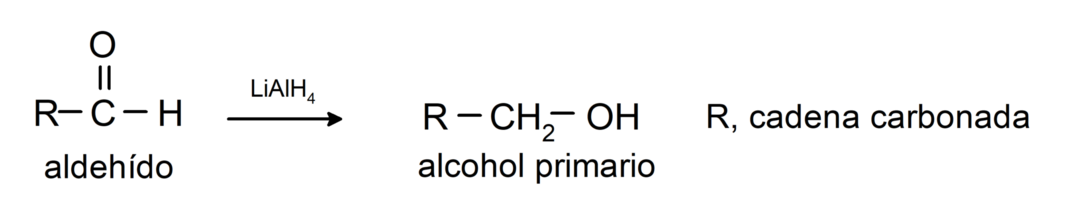
Nad läbivad redutseerimisreaktsioonid primaarseteks alkoholideks. Naatriumboorhüdriidi (NaBH4) ja liitiumalumiiniumhüdriidi (LiAlH4) juuresolekul või katalüütilise hüdrogeenimise teel redutseeritakse need primaarseteks alkoholideks. Näiteks:
Aldehüüdide näited
- metanaal (formaldehüüd)
- etanaal (atsetaldehüüd)
- propanaal (propaldehüüd)
- butanaal
- pentanal
- vanilliin
- kaneelimaldehüüd
- propenaal
- bensaldehüüd
- heksaanaal
- 3-bromotsüklopentaankarbaldehüüd
- tsükloheksaankarbaldehüüd
- 4,4-dimetüülpentanaal
- 2-hüdroksübutanaal
- 2-hüdroksü-2-metüülbutanaal
- 2,3-dimetüülpentanaal
- pentaaniaal
- tsüklopentaankarbaldehüüd
- isobutaal
- 2-klorobutanaal

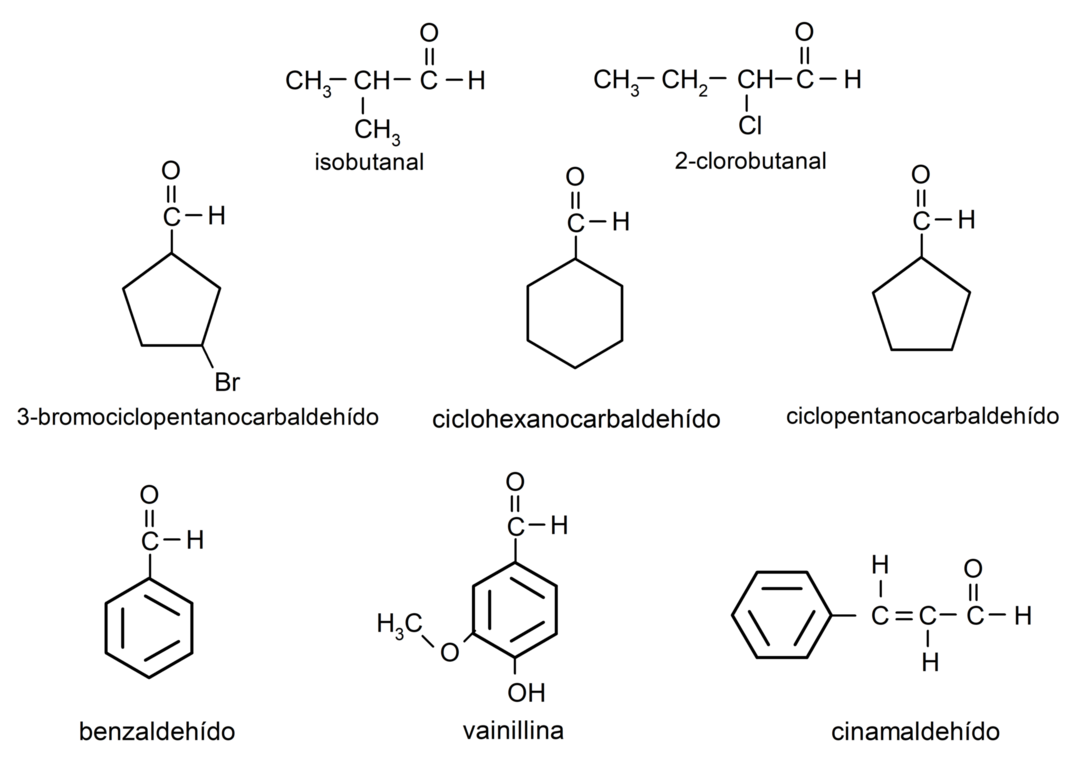
Aldehüüdid looduses
Mõned looduses esinevad aldehüüdid on:
- Bensaldehüüd, mandlite koostisosa.
- Cinnamaldehüüd, komponent, mis annab kaneeliessentsile selle lõhna.
- Vanilliin, komponent, mis annab vanillile selle maitse.
Teisest küljest on glükoosi ühel vormil, avatud kujul, funktsionaalne aldehüüdrühm.
Alkoholi metabolismi vaheühendina moodustuv atseetaldehüüd põhjustab alkoholijoobes pohmelli sümptomeid.
Aldehüüdide kasutamine
Mõned aldehüüdide peamised kasutusalad on järgmised:
- Neid kasutatakse lahustite, värvide, kosmeetikatoodete ja essentside tootmisel.
- Neid kasutatakse vaikude valmistamisel. Bakeliit on valmistatud formaldehüüdist ja on vaik, mis toimib väga hästi elektriisolaatorina.
- Neid on kasutatud rahustitena. Paraldehüüdi on kasutatud rahustava ja uinutina, kuigi nüüdseks on see ebameeldiva lõhna tõttu kasutusest väljas.
- Neid kasutatakse bioloogiliste proovide ja surnukehade säilitusainetena. Formaldehüüdi kasutatakse selles mõttes laialdaselt.
- Neid kasutatakse toidu maitseainetena. Näiteks vanilliin, mida kasutatakse magustoitudele vanilje aroomi andmiseks.
- Neid kasutatakse desinfektsioonivahenditena.
Aldehüüdide ohud
Mitmeid aldehüüde on peetud kantserogeenseteks, näiteks formaldehüüd on WHO (World Health Organization) järgi kuulutatud kantserogeenseks ühendiks.
Kokkupuude ja kokkupuude paljude aldehüüdidega põhjustab naha, silmade ja hingamisteede ärritust. Teisest küljest põhjustab see kontaktdermatiiti ja maksahaigusi.
Viited
- Solomons, T.W. Graham ja María Cristina Sangines Franchini (1985). “orgaaniline keemia”Mehhiko, D.F.: Limusa.
- Whiten, K. W., Gailey, K. D., Davis, R. E., de Sandoval, M. T. TO. O. ja Muradás, R. M. g. (1992). “Üldine keemia" (lk. 108-117). McGraw-Hill.
- Arteaga, P. M. (2017). “Ketoonid ja aldehüüdid” Ettevalmistuskooli Con-Science Teadusbülletään nr 3, 4(8).
Järgige:
- Suhkrud
- Hüdratsiidid
- Etüülalkohol
- Orgaanilised ja anorgaanilised ühendid



