30 näidet alkoholidest
Näiteid / / November 06, 2023
The alkoholid on orgaanilised keemilised ühendid mis sisaldavad oma struktuuris hüdroksüüli funktsionaalrühma (-OH), mis on seotud süsinikuga (-C). Rühma (-C – OH) nimetatakse karbinooliks. Mõned näited alkoholidest on järgmised: metanool, etanool ja 1-propanool.
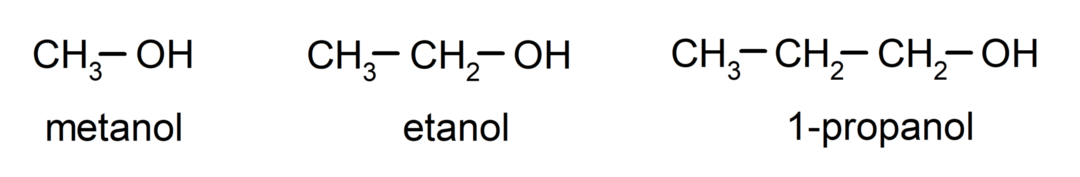
Alkoholid on keemilised ühendid, mida kasutatakse igapäevaelus mitmeti, kuna neil on antibakteriaalsed ja antiseptilised omadused. Teisest küljest võivad need kontrollimatul allaneelamisel olla ohtlikud inimeste tervisele.
Samuti ei saa inimene kõiki alkohole alla neelata.
- Vaata ka: Amiinid ja ketoonid
Alkoholide tüübid
Sõltuvalt süsinikuaatomite arvust, millega hüdroksüülrühmaga seotud süsinikuaatom on seotud, võib alkohol olla:
- Esmane alkohol. Süsinikuaatom, millel on hüdroksüülrühm, on samuti seotud ühe süsinikuaatomiga. Näiteks:
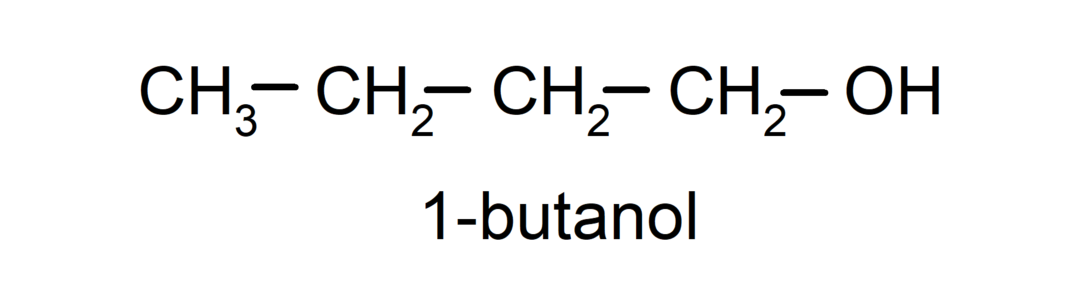
- Sekundaarne alkohol. Süsinikuaatom, mille hüdroksüülrühm on seotud, on seotud ka kahe teise süsinikuaatomiga. Näiteks:
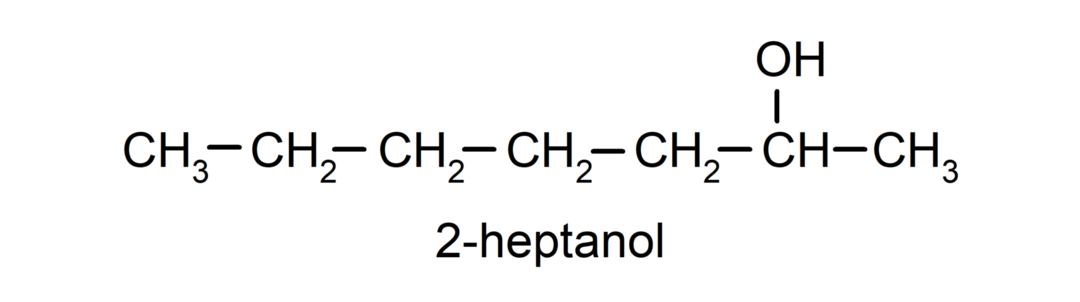
- Tertsiaarne alkohol. Süsinikuaatom, millel on hüdroksüülrühm, on samuti seotud kolme süsinikuaatomiga. Näiteks:
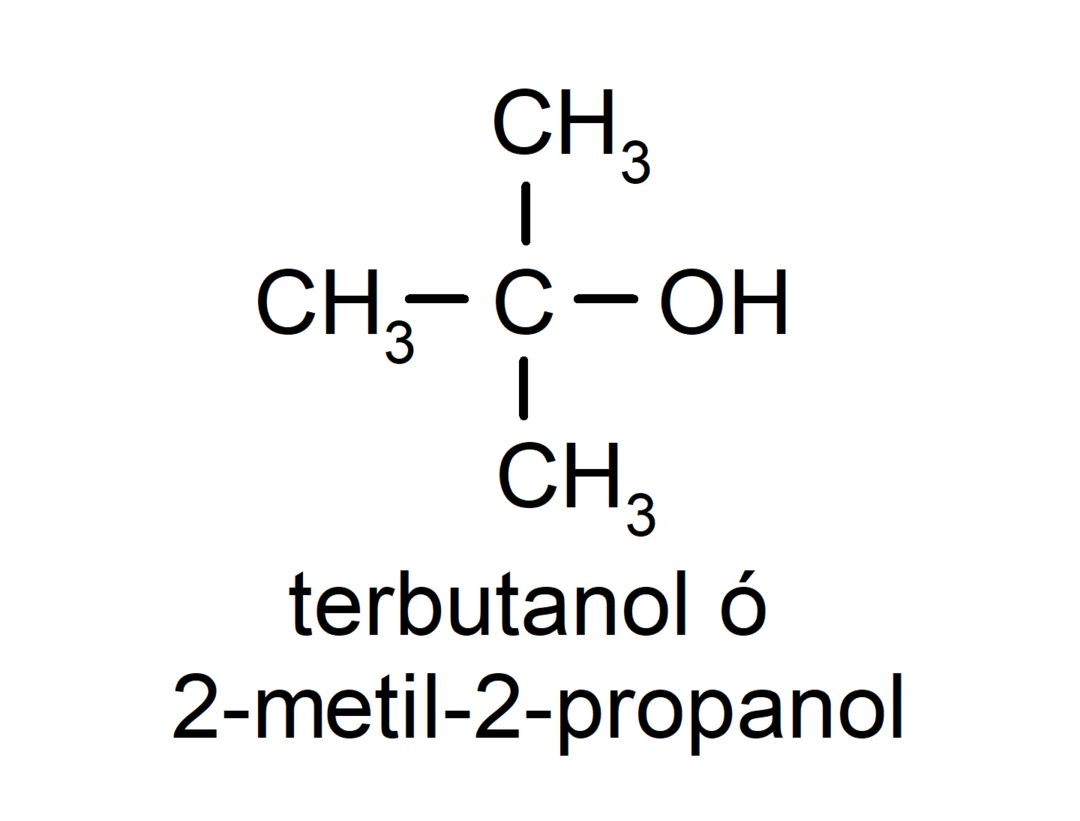
Sõltuvalt selles sisalduvate hüdroksüülrühmade arvust võib alkohol olla:
- Diol. Selle struktuuris on kaks hüdroksüülrühma. Näiteks:
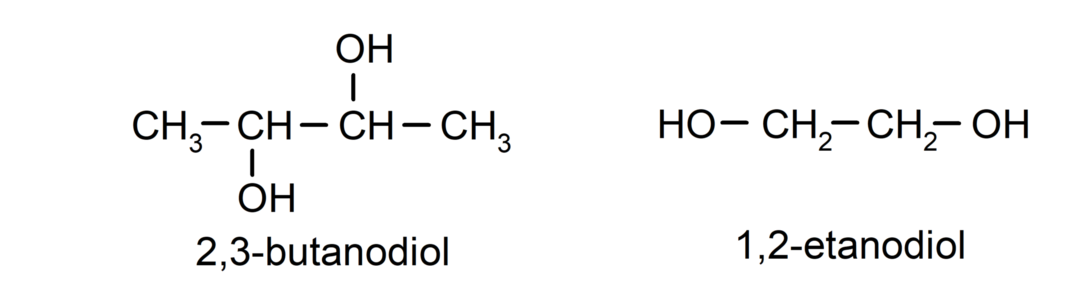
- Triol. Selle struktuuris on kolm hüdroksüülrühma. Näiteks:
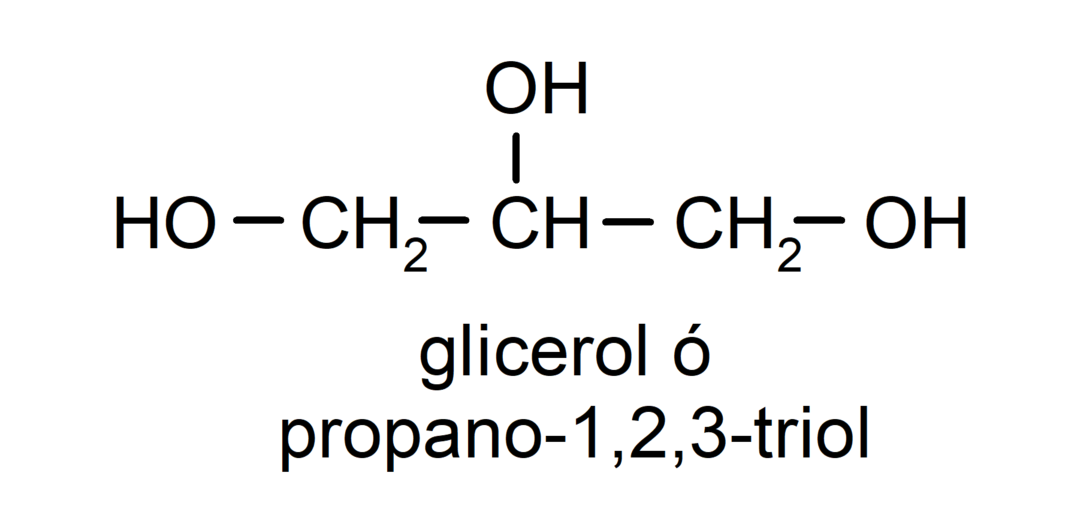
- Polüalkohol. Selle struktuuris on palju hüdroksüülrühmi. Näiteks:
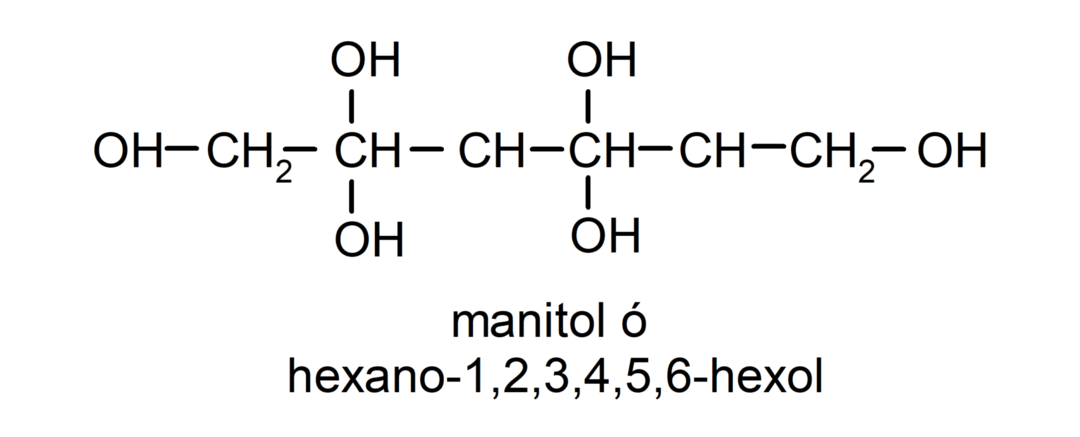
Alkoholide füüsikalised omadused
Mõned alkoholide füüsikalised omadused on järgmised:
- Keemispunkt. Keemistemperatuur alkoholides on küllalt kõrge hüdroksüülrühma olemasolu tõttu, mis võimaldab vesiniksidemeid moodustada. Veelgi enam, mida rohkem hüdroksüüli funktsionaalrühmi on süsinikuahelas, seda kõrgem on Keemispunkt alkoholidest.
- Polaarsus. Alkoholid on üsna polaarsed ühendid.
- Lahustuvus. Madala molekulmassiga alkoholid lahustuvad vees. Teisest küljest, mida suurem on alkoholide süsinikuahel, seda madalam on nende lahustuvus vees. Lisaks, mida rohkem on alkoholidel hüdroksüülrühmi, seda suurem on nende lahustuvus vees.
- Koondamisseisund. Enamik alkohole on toatemperatuuril (25ºC) vedelad ja iseloomuliku lõhnaga.
Alkoholide keemilised omadused
Mõned alkoholide keemilised omadused on järgmised:
- Alkoholid käituvad nagu happed ja alused.. Nende käitumist hapetena võib näha reaktsioonides aktiivsete metallidega gaasilise vesiniku vabanemiseks ja alkoksiidide moodustumiseks.

Nende käitumist alustena võib näha sellistes reaktsioonides nagu metanooli reaktsioon vesinikbromiidiga, moodustades metüüloksooniumbromiidi.
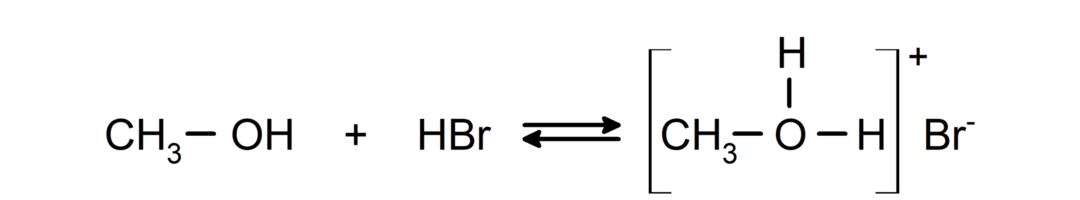
- Alkoholid läbivad halogeenimisreaktsioone. Nad reageerivad vesinikhalogeniididega, moodustades alküülhalogeniidid.
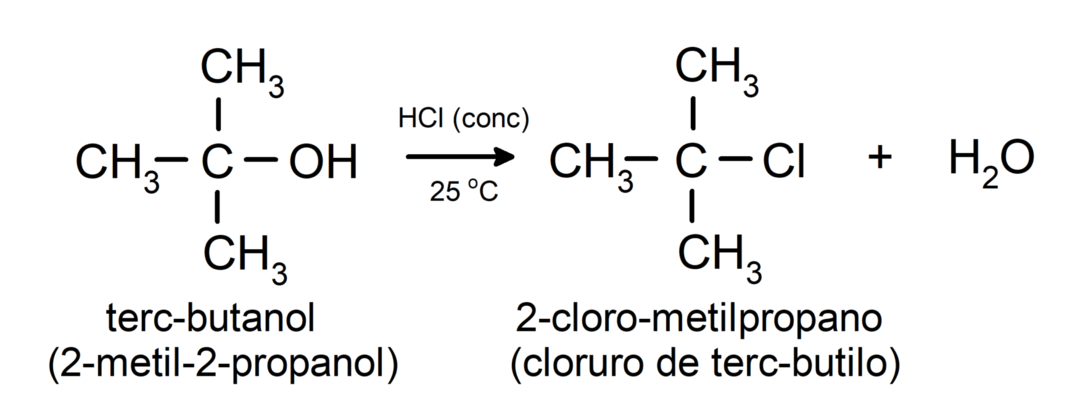
-
Alkoholid läbivad oksüdatsioonireaktsioone kui nad reageerivad teatud oksüdeerivate ühenditega. Oksüdatsioonireaktsiooni produktid sõltuvad reageeriva alkoholi tüübist, st kas see on primaarne, sekundaarne või tertsiaarne.
Primaarse alkoholi oksüdeerimine aldehüüdi või karboksüülhappe moodustamiseks.
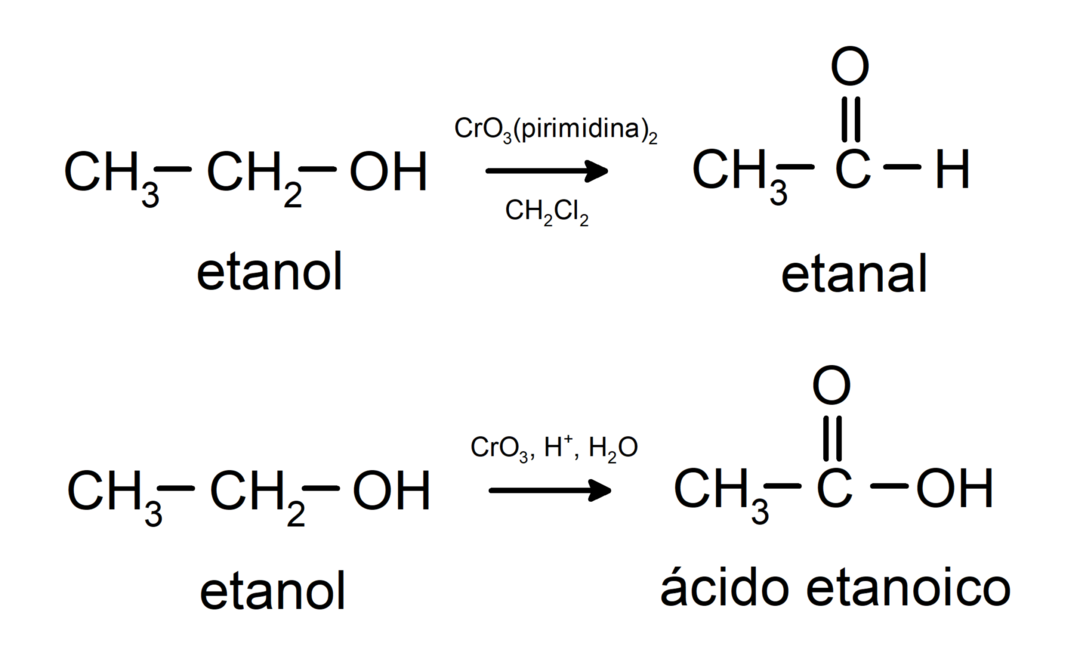
Sekundaarse alkoholi oksüdeerimine ketooni moodustamiseks.
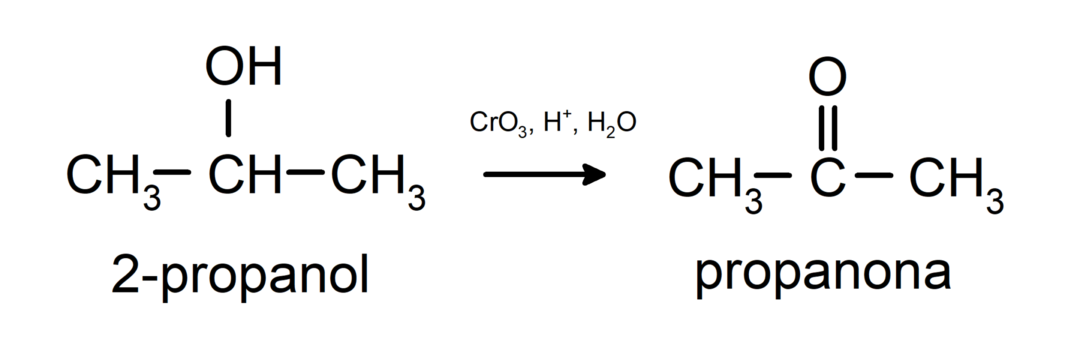
Tertsiaarsed alkoholid ei oksüdeeru tavaliste oksüdeerijatega. Väga tugevate oksüdeerivate ainetega saab neid muuta alkeenideks, mida saab seejärel oksüdeerida.
Alkoholid, millel on kaks hüdroksüülrühma, mis asuvad kõrvuti asetsevates süsinikuaatomites, oksüdeeritakse pliitetraatsetaadiga, moodustades kaks ketooni.
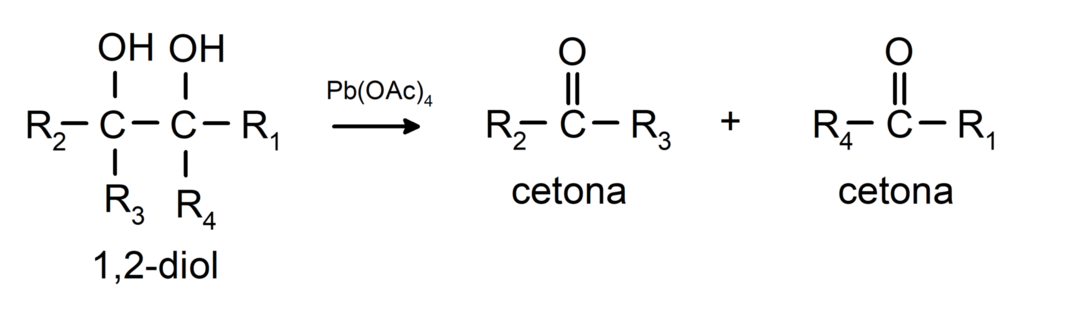
- Alkoholid läbivad dehüdrogeenimisreaktsioone. Need reaktsioonid toimuvad ainult primaarsete ja sekundaarsete alkoholidega, mis katalüsaatorite juuresolekul kõrgel temperatuuril vabastavad vesinikke.
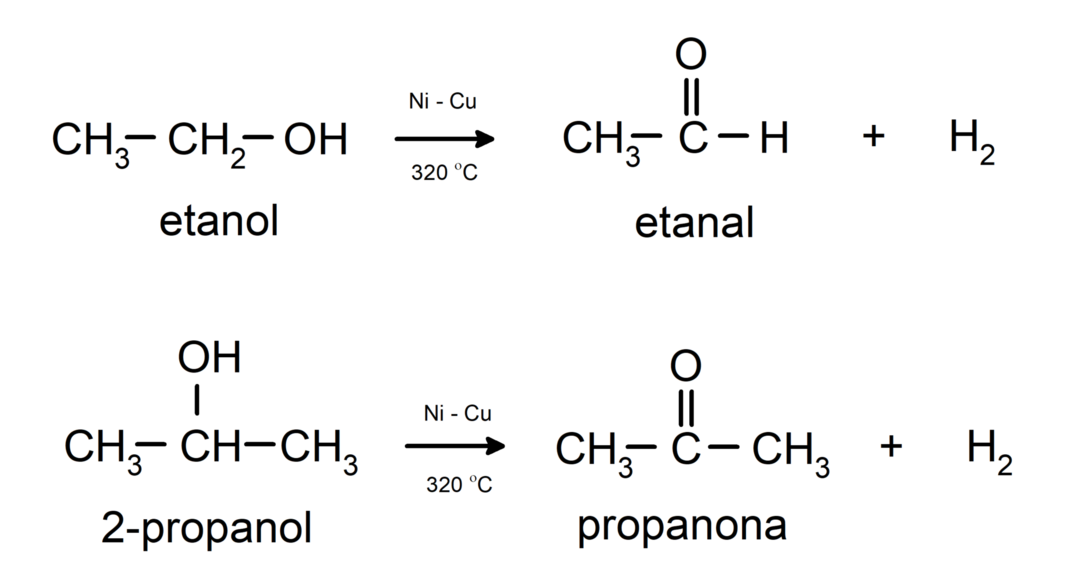
- Alkoholid läbivad dehüdratsioonireaktsiooni. Alkoholid dehüdreeruvad, moodustades vastavad alkeenid. See reaktsioon toimub happe ja vahepealse temperatuuri juuresolekul.
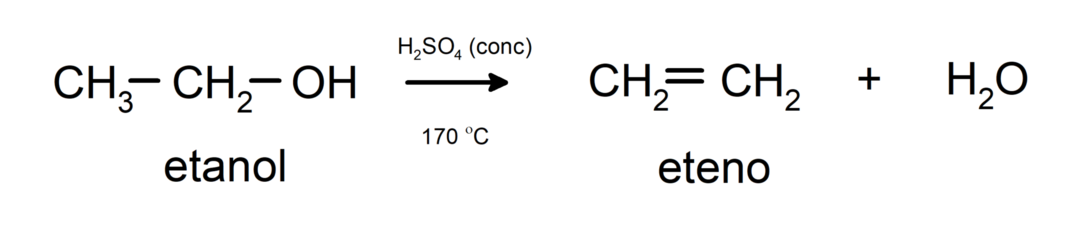
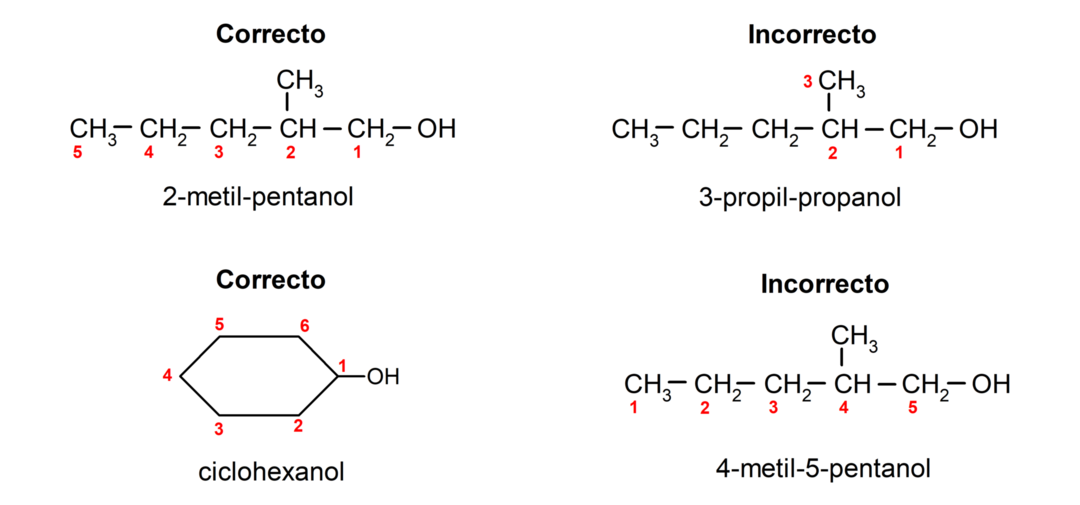
Alkoholi nomenklatuur
Vastavalt IUPAC-i (International Union of Pure and Applied Chemistry) kehtestatud nomenklatuurile nimetatakse alkoholid järgmiste reeglite järgi:
- Hüdroksüülrühma asend valitakse, võttes arvesse, et see hõivab süsinikuahelas väikseima võimaliku arvu. Kui alkoholi struktuur on tsükliline, võetakse arvesse 1. asendit süsinikul, millega on seotud hüdroksüülrühm, ja selle nimetamiseks kasutatakse eesliidet cyclo-.
- Alkoholi nime kirjutamisel kasutatakse eesliiteid, mis näitavad süsinikuahelas olevate aatomite arvu, ja lisaks pannakse järelliide -ol.
- Kui alkoholi struktuuris on harusid, valitakse peamiseks süsinikuahelaks pikim ahel, mis sisaldab ka hüdroksüülrühma.
Traditsioonilise nomenklatuuri järgi nimetatakse alkoholidele sõna "alkohol" ja seejärel alkoholi nimetuse kirjutamisega. süsiniku ahelale vastav alkaan, kuid alkaani -aan-lõpu asemel kasutatakse lõppu -ülliline.
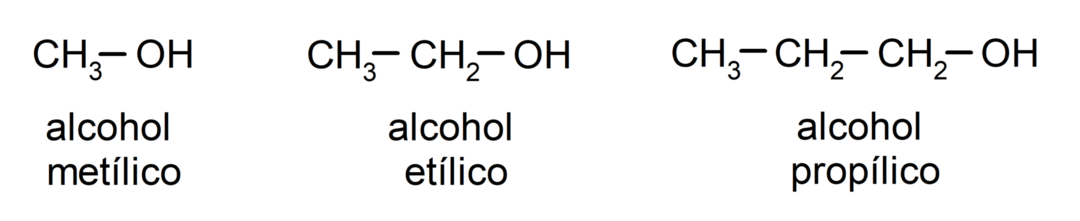
Alkoholide näited
- metanool
- etanool
- 1-propanool
- 2-propanool
- 1-butanool
- 3-etüülheksaan-2-ool
- glütserool
- fenool
- 2-metüül-2-butanool
- 1,2-etaandiool
- 1,5-heptadieen-3-ool
- 3-metüül-2-butanool
- bensüülmetanool
- 3-pentanool
- 2-metüülfenool
- 1,2-dihüdroksüfenool
- tsükloheaksnool
- 1-fenüületanool


Alkoholide kasutamine
Alkoholi kõige levinumad kasutusalad on:
- Neid kasutatakse desinfektsioonivahendite ja antiseptikumidena, kuna need peatavad mõne kasvu mikroorganismid või neid hävitada. Selleks kasutatakse enim etanooli ja isopropüülalkoholi.
- Neid kasutatakse erinevate sünteesimisel keemilised ühendid. Metanaali (formaldehüüdi) saamiseks kasutatakse näiteks metanooli.
- Neid kasutatakse antifriisi tootmiseks. Metanool on selleks otstarbeks üks enim kasutatud.
- Neid kasutatakse farmaatsiatööstuses lahustitena. Etanool on selles mõttes üks enim kasutatud.
- Neid kasutatakse lakkide, värvainete ja tintide lahustitena. Selleks kasutatakse laialdaselt metanooli.
- Neid kasutatakse kütusena ja on oluline tendents osaliselt asendada fossiilkütused bioetanoolkütuse kasutamisega.
- Neid kasutatakse vaikude valmistamiseks. Fenooli kasutatakse selles mõttes.
Alkoholi tarbimise ohud
Kuigi alkoholi tarbimine on tänapäeval ühiskonnas aktsepteeritud, tekitab selle aine kuritarvitamine sõltuvust ja sõltuvust.
Etanool on alkohoolsetes jookides sisalduv alkohol, mis liigne tarbimine mõjutab kognitiivseid võimeid ning võib põhjustada südame-veresoonkonna haigusi, maksatsirroosi ja vähk.
Peale selle, kui saavutatakse alkoholijoobe aste ehk joobeseisund, kui Kui alkoholi on liiga palju, võib tekkida alkohoolne kooma, mis võib põhjustada hingamisteede halvatust ja isegi surma. surma.
Viited
- T. TO. Geissman. (1974) “Orgaanilise keemia põhimõtted” teine trükk. Toimetaja Reverté, S.A. ISBN: 8429171800
- Ahumada-Cortez, J. G., Gámez-Medina, M. E. ja Valdez-Montero, C. (2017). Alkoholi tarbimine kui rahvatervise probleem. Ra Ximhai, 13(2), 13-24.
- Morrison, R. T. ja Boyd, R. N. (1998). Orgaaniline keemia. Pearsoni haridus.
- Weininger, S. J. ja Stermitz, F. R. (1988). Orgaaniline keemia. Ma pöörasin tagurpidi.
Järgige:
- Etüülalkohol
- Kütused
- orgaaniline keemia



