30 näidet binaarsest müügist
Näiteid / / November 09, 2023
The binaarsed soolad (neutraalsed soolad) tekivad metalli ja mittemetalli kombineerimisel. Are keemilised ühendid koosneb ainult kahest keemilised elemendid. Näiteks: naatriumkloriid (NaCl) ja kaaliumbromiid (KBr).
- Vaata ka: Metallid ja mittemetallid
Näited binaarsetest sooladest
- Naatriumkloriid (NaCl)
- Raud(II)kloriid (FeCl2)
- Raud(III)kloriid (FeCl3)
- Koobalt(II)sulfiid (CoS)
- Koobalt(III)sulfiid (Co2Jah3)
- Plii(II)sulfiid (PbS)
- Plii(IV)sulfiid (PbS2)
- Kaltsiumkloriid (CaCl2)
- Naatriumfluoriid (NaF)
- Liitiumkloriid (LiCl)
- Strontsiumkloriid (SrCl2)
- Baariumkloriid (BaCl2)
- Alumiiniumkloriid (AlCl3)
- Magneesiumsulfiid (MgS)
- Rubiidiumkloriid (RbCl)
- Kaltsiumbromiid (CaBr2)
- Kaaliumsulfiid (K2S)
- Magneesiumbromiid (MgBr2)
- Tsinksulfiid (Zn2S)
- Liitiumbromiid (LiBr)
- Nikkelkloriid (NiCl2)
- Uraan(III)kloriid (UCl3)
- Hõbebromiid (AgBr)
- Hõbejodiid (AgI)
- Kaaliumbromiid (KBr)
Binaarsete soolade nomenklatuur
Traditsioonilise nomenklatuuri järgi nimetatakse binaarseid soolasid, kirjutades mittemetallilise elemendi nime lõpuga -ide. Teisest küljest kirjutatakse metallilise elemendi nimi vastavalt selle oksüdatsiooniastmele:
- Madalaima oksüdatsiooniastme puhul kirjutatakse see lõpuga -oso. Näiteks: raudkloriid (FeCl2), kus raua oksüdatsiooniaste on 2+.
- Kõrgeima oksüdatsiooniastme jaoks kirjutatakse see lõpuga -ico. Näiteks: raud(III)kloriid (FeCl3), kus raua oksüdatsiooniaste on 3+.
Süstemaatilise nomenklatuuri järgi nimetatakse binaarseid soolasid, kirjutades mittemetallilise elemendi nime prefiksiga, mis näitab soola kogust. aatomid selle elemendi kohta ühendis. Lisaks pannakse mittemetallilise elemendi nimesse lõpp -uro. Seejärel asetatakse metallelemendi nimi. Näiteks: magneesiumdikloriid (MgCl2) ja raudtrikloriid (FeCl3).
Stocki nomenklatuuri järgi nimetatakse binaarseid soolasid, kirjutades mittemetallilise elemendi nime lõpuga -ide. Seejärel lisatakse metallilise elemendi nimi, millele järgneb selle oksüdatsiooniaste, mis on kirjutatud rooma numbritega ja sulgudes. Näiteks: raud(II)kloriid (FeCl2) ja koobalt(III)sulfiid (Co2Jah3).
Binaarsete soolade rakendused
- Neid kasutatakse külmutusagensitena toiduaine- ja farmaatsiatööstuses. Näiteks: kaltsiumkloriid (CaCl2).
- Neid kasutatakse metallpindade korrosioonivastaseks töötlemiseks. Näiteks: naatriumfluoriid (NaF).
- Neid kasutatakse niiskuse reguleerimiseks paberi- ja ehitustööstuses. Näiteks: kaltsiumkloriid (CaCl2).
- Neid kasutatakse klaasitööstuses lisandite eemaldamiseks. Näiteks: ränitetrakloriid (SiCl4).
- Neid kasutatakse toiduvalmistamise koostisosadena. Näiteks: naatriumkloriid (NaCl).
Binaarsete soolade füüsikalised omadused
- Neil on kõrge sulamistemperatuur, kuna need koosnevad ioonsed sidemed.
- Nad juhivad elektrivoolu lahustumisel või sulamisel.
- Kõige tavalisemad soolad on madala karedusega.
- Need ei ole kokkusurutavad.
- Enamik neist võib vees lahustuda.
Kuidas saadakse binaarseid sooli?
Binaarseid sooli saab saada järgmiste keemiliste reaktsioonide kaudu:
Reaktsioon metalli ja mittemetalli vahel. Näiteks: reaktsioon naatriumi (Na) ja dikloriidi (Cl2) toodab naatriumkloriidi (NaCl).
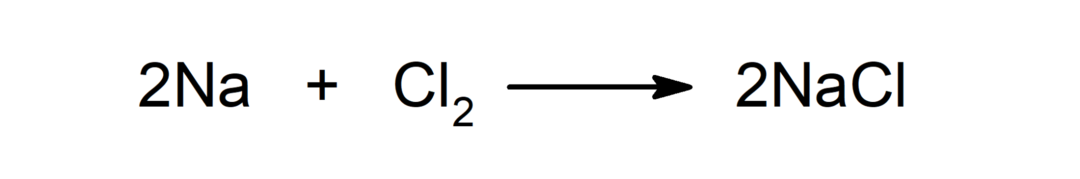
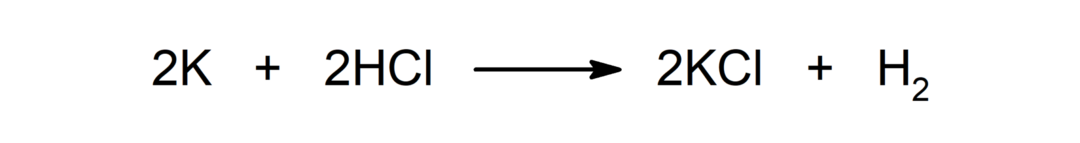
Reaktsioon metalli ja happe vahel. Näiteks: Kaaliumi (K) ja vesinikkloriidhappe (HCl) vaheline reaktsioon tekitab kaaliumkloriidi (KCl) ja divesinikku (H)2).
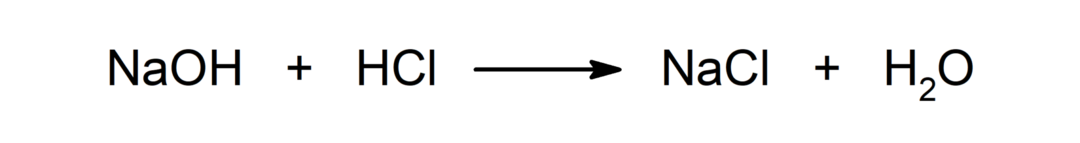
Reaktsioon happe ja aluse vahel. Näiteks: Reaktsioon vesinikkloriidhappe (HCl) ja naatriumhüdroksiidi (NaOH) vahel tekitab naatriumkloriidi (NaCl) ja vett (H2KAS).
Järgige:
- oksüsoolad
- neutraalsed soolad
- happe soolad
Viited
- Cerón Villalba, A., Novoa Ramírez, C. S. ja Alpizar Juárez, E. (2020). Nomenklatuuri video 1: binaarsed soolad ja keemiline reaktsioon.
- Acurio Arias, M. V. ja Delgado Méndez, M. JA. (2022). Mängupõhine õppejuhend kahendühendite jaoks keskkooli keemias õppeüksuses "Herlinda Toral" (Bakalaureusetöö, National University of Education).
- Cabrera, M. J. H. (2005). Uuring kahe- ja kolmekomponentsete ühendite elektrooniliste ja struktuursete omaduste esimestest põhimõtetest (Doktoritöö, La Laguna Ülikool).


