Endotermiliste reaktsioonide näited
Näiteid / / November 09, 2023
A endotermiline reaktsioon See on reaktsioon, mis neelab keskkonnast energiat soojuse kujul. Nendes reaktsioonides on reaktiivide produktideks muundumiseks vajalik, et nad neelaksid soojust, mis põhjustab toodetel suuremat energiat kui neid tekitanud reagentidel. Mõned näited endotermilistest reaktsioonidest on järgmised: fotosüntees ja vee elektrolüüs.
- Vaata ka: Keemilised reaktsioonid
Näited endotermiliste reaktsioonide kohta igapäevaelus
Mõned peamised endotermilised reaktsioonid on:
Osooni tootmine atmosfääris. Osoon tekib atmosfääris, kui molekulaarne hapnik (O2) neelab ultraviolettkiirgust ja laguneb. Siis saab hapnikuaatom (O) suhelda teise hapnikumolekuliga (O2) ja moodustavad osooni (O3).

Vee elektrolüüs. See on protsess, mille abil seda rakendatakse elektrienergia vette, et eraldada see kaheks komponendiks, vesinikuks (H) ja hapnikuks (O).
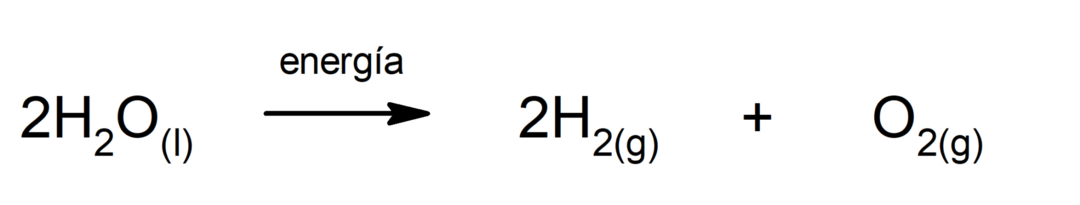
Fotosüntees. See on keemiline reaktsioon, mille käigus neelab päikeseenergia, süsinikdioksiid (CO2) muundatakse glükoosiks. See reaktsioon on taimede peamine toitumisviis.
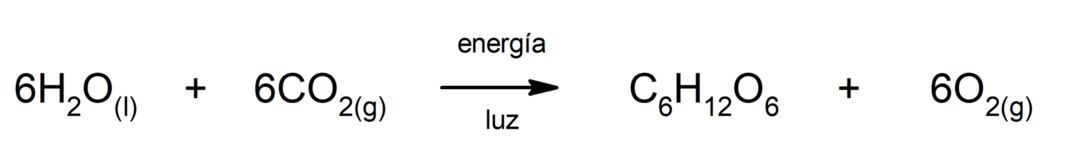
Raud(II)sulfiidi tootmine. Väävli ja raua vahelise reaktsiooni toimumiseks on vaja anda energiat soojuse kujul.
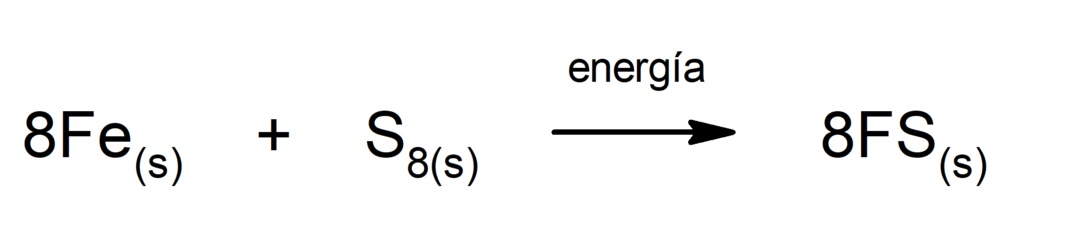
Süsinikdioksiidi lagunemine (CO2). CO lagunemine2 Kõrgel temperatuuril toodab süsinikmonooksiidi (CO) ja hapnikku (O2).
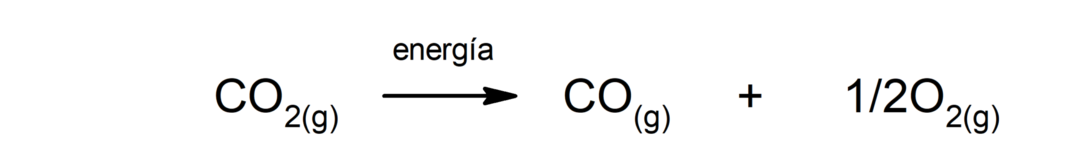
Kaltsiumkarbonaadi (CaCO3). Kaltsiumkarbonaat laguneb soojuse neeldumisel, moodustades kaltsiumoksiidi (CaO) ja süsinikdioksiidi (CO)2).
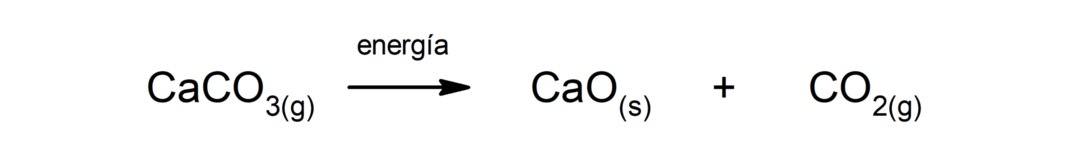
Erinevus endotermilise ja eksotermilise reaktsiooni vahel
Peamine erinevus endotermiliste ja eksotermiliste reaktsioonide vahel seisneb selles, et endotermilised reaktsioonid neelavad soojust, samas kui eksotermilised reaktsioonid eraldavad soojust.
Lisaks iseloomustab endotermilisi reaktsioone entalpia suurenemine, samas kui eksotermilisi reaktsioone seostatakse entalpia vähenemisega.
Entalpia on termodünaamiline suurus, mis määratleb soojusenergia voolu konstantsel rõhul keemilise reaktsiooni ajal. Seda tähistab täht H ja selle varieerumine on üks peamisi näitajaid, mis määravad, kas keemiline reaktsioon on endotermiline või eksotermiline.
- Kui keemilise reaktsiooni entalpia muutus on suurem kui null (ΔH > 0) on endotermiline.
- Kui keemilise reaktsiooni entalpia muutus on väiksem kui null (ΔH < 0) on eksotermiline.
Järgige:
- Füüsikalis-keemilised nähtused
- Keemia igapäevaelus
- Keemia igapäevaelus
- Orgaaniline ja anorgaaniline keemia
Viited
- Soto-Córdoba, S. (2016). Endotermilised reaktsioonid. Tehnikahoidla Costa Rica Tehnoloogiainstituut.
- Corominas, J. (2017). Igapäevaelu keemilised reaktsioonid. Alembic, (90), 8-26.
- Sánchez, M. T. M. ja Sánchez, M. M. (2002). Endotermiliste reaktsioonide eksperimentaalne uuring ESO õpilastele. RSEQ keemia aastaraamatud, (4), 36-39.

