Mahulise analüüsi näide
Keemia / / July 04, 2021
Peal Analüütiline keemia, Volumetria on analüüsimeetod, mis koosneb Analüütiga stöhhiomeetriliselt reageerimiseks vajaliku reagendi mahu mõõtmine, mis on aine, mis tuleb kindlaks määrata.
Reageerige stöhhiomeetriliselt Termin "kemikaal" viitab ainetele, mis vastavalt kemikaalile reageerivad keemiliselt proportsioon, mis tähistab keemilist võrrandit juba tasakaalus.
Uuritavat ainet nimetatakse Analüüt. Selle aine prooviks võetakse teadaolev ja täpselt mõõdetud maht, mida me nimetame Alikvoot, mis sisaldub analüüsi alustamiseks Erlenmeyeri kolvis.
Mahulise analüüsi mõisted
Volüüriline analüüs, olles tüüp Keemiline analüüs, kandma kaasatud keemiline reaktsioon. See keemiline reaktsioon viiakse läbi uuritava aine tundmatu koguse proovi ja teise aine teadaoleva koguse vahel, mis on võimeline esimesega reageerima.
The Reaktsiooniained on vesilahusesja mõõdetakse reaktsiooni lõpuni reageerinud lahuste mahud, mis on nähtavad tänu indikaatorile, mis annab värvi kolvis.
Volumetrilises analüüsis on lahuse vesilahus
Tuntud kontsentratsiooni nimetatakse standardlahenduseks, Standard või Tiitrantja on reaktsiooni lõpetamiseks võrdlusaluseks, et teha arvutus, mis näitab uuritava aine kogust.Seda mõlema lahuse reageerima panemise protseduuri nimetatakse Keemiline kraad o Hindamine, mis on mahulise analüüsi põhiosa. Koosneb minekust järk-järgult standardlahust valades (Tiitrant) alikvoodis (Näide), kuni indikaator näitab muutust värvierinevusega.
A Näitaja See on keemiline aine, mis lisatakse alikvoodile, millel on värvus ja mis reaktsiooni lõppedes muudab värvi.
Mahuline analüüs koosneb lihtsast sammude reast:
1.- Standardlahuse valmistamine
2.- Proovi või alikvoodi ettevalmistamine
3.- keemiline kraad
4.- mahu mõõtmine
5. Uuritava aine arvutamine.
Kuni selleni, et nad on seda juba teinud täielikult reageerinud neid kahte ainet nimetatakse Samaväärsuse punkt.
Nagu mis tahes keemilises analüüsimeetodis, on ka mahtanalüüsis heade tulemuste nõuded:
- Keemiline reaktsioon peab olema Valikulinesee tähendab, et standardlahus reageerib ainult prooviga.
- Keemiline reaktsioon peab olema Stöhhiomeetrilineehk järgida tasakaalustatud keemilises võrrandis märgitud proportsioone.
- Keemiline reaktsioon peab olema Kvantitatiivne; viitab 99,9% -lisele täitmisele samaväärsuspunktis.
- Peab olema a tuvastatav lõpp-punkt reaktsioonis, mida näitaja paremini kinnitab.
Esmane muster
The Esmased mustrid Need on kõrge puhtusastmega ained, mille kontsentratsioon lahuses arvutatakse otse kaalutud koguse ja kasutatud vee mahu põhjal.
A) Jah, saab reageerida töötavate lahendustega, et teada viimaste kontsentratsioonid ja teisendada need standardlahusteks.
Esmaste mustrite näited on:
-Naatriumkarbonaat (Na2CO3): Kasutatakse hapete, näiteks väävelhappe standardiseerimiseks.
-Kaaliumbiftaal: põhialus on selliste baasilahuste nagu naatriumhüdroksiid valmistamine.
-Naatriumkloriid (NaCl): seda kasutatakse hõbenitraadi lahuste standardiseerimiseks.
-Kaltsiumkarbonaat (CaCO3): EDTA (etüleendiamiini tetraäädikhappe) peamine standard.
Esmane muster peab vastama mitmele olulisele tunnusele:
Peab olema Kõrge puhtusastmega, Atmosfääri stabiilsus, Hüdratatsioonivee puudumine, Madal hind ja seda on lihtne saada, Y Suur ekvivalentkaal.
Volumetrilise analüüsi klassifikatsioon
Sõltuvalt keemilistest liikidest, kellega analüüsi tegemisel töötate, on see volumetria tüüp:
Happe-aluse maht: Kas happe või alusega analüüsitakse happeid või aluseid sisaldavaid proove.
Sademete maht: Seda nimetatakse ka argomeetriaks, et määrata proovis olevate kloriidide määramiseks hõbenitraadi standardlahus.
Keerukuse maht: Kõvaduse, see tähendab kaltsiumi ja magneesiumkarbonaatide kontsentratsiooni mõõtmiseks vees, kasutatakse kompleksiaine, näiteks EDTA, standardlahust.
REDOXi maht: Reaktsioon toimub oksüdeeriva aine ja redutseeriva aine vahel.
Näitajad
Volumetricsis kasutatavatest arvukatest näitajatest paistab silma kolm:
1.- Metüüloranž: Alikvoodis on oranž värvus, mida tiitritakse happega. Kui ekvivalentpunkt on saavutatud, muutub indikaator kollaseks.
2.- Fenolftaleiin: Alikvoodis, mis saab pealkirjaga aluse, on see alguses läbipaistev. Kui ekvivalentpunkt on saavutatud, muutub indikaator roosaks.
3.- Eriokroommust: Seda indikaatorit kasutatakse kareduse määramiseks vees. Alguses on see alikvoodis purpurpunane, kuni seda tiitritakse kompleksiainega. Reaktsiooni lõpus muutub see siniseks.

Instrumendid mahuanalüüsis
Mahulises analüüsis kasutatakse mitut instrumenti, mida, kui neid pole, ei saa piisavalt välja töötada:
1. - mõõtekolb: see on alumises osas lambi moodi anum, mille põhjas on lamestatud ja millel on õhuke kolonn, kuhu lisatakse vedelik. Sellel on märk, mis näitab vedeliku meniski asukohta, nii et see kataks täpse mahu. Seda kasutatakse standardlahenduste sisaldamiseks; tänu selle mahu täpsusele tagatakse teadaolev kontsentratsioon.

2.- Pipetid: need on gradueeritud õhukesed torud, mis võimaldavad mõõta usaldusväärselt täpseid vedeliku koguseid. Neid on saadaval kuni 25 milliliitrini ja need võimaldavad täpset proovide võtmist.
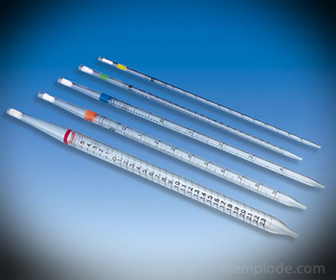
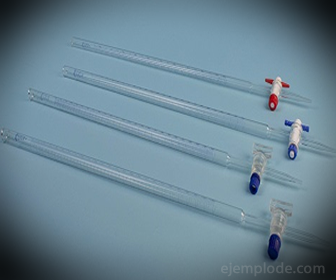
3. - bürett: see on piklik toru, mille maht on 50 milliliitrit ja mis sisaldab standardlahust. Selle ühes otsas on voolu reguleeriv ventiil, mis juhib lahuse alikvooti.
4. - Erlenmeyeri kolvid: need on sileda põhjas koonilise kujuga anumad, mis lõpevad silindrilise servaga. See disain muudab need keemiliste tiitrimiste jaoks sobivaks, kuna need ei lase lahuste raputamisel neid üle voolata. Usaldusväärse tulemuse tagamiseks on korduvate testide tegemiseks vaja vähemalt kolme.

Arvutused mahuanalüüsis
Vesilahuste käsitlemisel on mahulise analüüsi jaoks olulised kogused kontsentratsioon ja maht.
Volumetria põhivõrrand põhineb neljal põhiandmel:
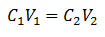
C1= Proovi kontsentratsioon (teadmata)
V1= Alikvoodi maht, millega analüüs töötati
C2= Ekvivalentsuspunkti saavutamiseks kasutatud standardlahuse kontsentratsioon
V2= Reaktsiooni lõpuni jõudmiseks vajalik ruumala standardlahus
Andmed asendatakse võrrandis, teadmata on ainult soovitud kontsentratsioon. Muidugi peavad kõik andmed olema samadel draividel.
Mahulise analüüsi näited
Kloriidide (Cl) määramine argentomeetriliselt hõbenitraadiga.
Bromiidide (Br-) määramine argentomeetriliselt hõbenitraadiga.
Tsüaniidide (CN-) määramine argentomeetriliselt hõbenitraadiga.
Magneesiumkarbonaadi (MgCO) määramine3), kompleksomeetriliselt EDTA-ga.
Kaltsiumkarbonaadi (CaCO2) määramine3), kompleksomeetriliselt EDTA-ga.
Väävelhappe analüüs (H2SW4) naatriumhüdroksiidiga (NaOH).
Naatriumhüdroksiidi (NaOH) analüüs vesinikkloriidhappega (HCl).
Antimoni (III) määramine kaaliumpermanganaadiga (KMnO4).
Arseeni (III) määramine kaaliumpermanganaadiga (KMnO4).
Titaani (III) määramine kaaliumpermanganaadiga (KMnO4).
Molübdeeni (III) määramine kaaliumpermanganaadiga (KMnO4).
Raud (II) määramine kaaliumpermanganaadiga (KMnO4).
Oksalaatioonide määramine kaaliumpermanganaadiga (KMnO4).



