Orgaanilise keemia näide
Keemia / / July 04, 2021
The Orgaaniline keemia See on uuringu ja keemiliste ühendite funktsionaalse klassifikatsiooni eest vastutav üldkeemia osa, mille struktuurielement on Süsinik, mida esineb rohkesti elus aine; See loob anorgaanilise keemia väga diferentseeritud universumi, mis on pühendatud mineraalidena klassifitseeritud keemilistele ühenditele.
Süsiniku aatomil on selle elektroonilise konfiguratsiooni viimases kestas neli elektroni. See omadus koos aatomi raadiusega võimaldab seda ühendada kovalentsete sidemetega teistega sama elemendi aatomid, moodustades arvukates ahelates suure hulga keemilisi ühendeid stabiilne.
Saate kontrollida Kovalentsed sidemed.
Sellised keemilised ühendid sisaldavad lisaks süsinikuaatomitele, mis annavad neile ürgstruktuuri, süsinikvalentsi peamise täiendina vesiniku aatomid. Lisaks on selles ühendite mitmekesisuses hapniku aatomite sekkumisega ühendid, Lämmastik, halogeenid, väävel ja isegi fosfor, leelismuldmetallid ja leelismuldmetallid üleminek. Sõltuvalt sellest, kes molekulis osaleb, on see lõpliku aine füüsikalised ja keemilised omadused.
The orgaanilised ühendid on olemas kogu elus aine; kõiki edendada ja toetada bioloogilised funktsioonid, erinevalt anorgaanilistest või mineraalsetest ainetest, mida inimesed on kasutanud ärilistel eesmärkidel, katsetamiseks või teatud koduste ülesannete täitmiseks.
Orgaanilise keemia ajalugu
Enne 1828. aastat tehti vahet juba orgaanilise keemia ja anorgaanilise keemia vahel. Orgaanilist ainet seostati loominguga a "eluline jõud"ja anorgaanilisele koos eluta, mineraaliga. Neid kontseptsioone arvestades ei saa eeldada, et laboris saab orgaanilisi ühendeid anorgaanilistest materjalidest.
Kuid, aastal 1828 Friedrich Wöhler (1800-1882) õnnestus valmistada orgaaniline aine, Karbamiidi CO (NH2)2, mis on loomade ainevahetuse oluline saadus, anorgaanilistest ühenditest. Ravi Plii tsüanaat Pb (CNO)2 koos Ammoniaak NH3 saada Ammooniumtsüanaat NH4CNO; See ühend moodustus tõepoolest, kuid kui lahust keedeti ammooniumtsüanaadi kristallimiseks, muundati see karbamiidiks.
See keemiline muutus on näide Sisemine ümbergruppimine, milles molekuli aatomite arv või klass ei muutu, vaid ainult nende järjestus selle sees. Seda tüüpi transformatsioonid on orgaanilises keemias väga levinud.
Wöhleri avastus algatas hiljem elujõu teooriast loobumise täielikult kõrvaldatud, millele järgneb paljude teiste orgaaniliste ühendite valmistamine laboratoorium. Vaatamata sellele püsivad anorgaaniliste ja orgaaniliste omaduste määratlused, kuna anorgaanilised ühendid on seotud mineraalsete toodetega ja orgaanilised ühendid, mis on tegelikult süsiniku ja vesiniku ühendid ning nende derivaadid, on elusorganismide toodetud tüüpi.
Ehkki üldkeemia seadused kehtivad mõlemale ühendile võrdselt, õigustavad ja teevad selle jaotuse vajalikuks erinevad põhjused. Seega erinevad orgaanilised ja anorgaanilised ühendid erinevate omaduste poolest, näiteks: nende Lahustuvus eelistatud orgaanilistes lahustites (eeter, alkohol, kloroform jne) ja vastavalt vees Stabiilsus (orgaanilised ühendid lagunevad suhteliselt madalatel temperatuuridel) ja Reaktsioonide olemus; anorgaaniliste ühendite puhul on need ioonsed, lihtsad ja praktiliselt momentaansed ning orgaaniliste ühendite korral kovalentsed, keerukad ja aeglased.
Orgaanilised ühendid
On teada süsinikuühendid, mille ahelad on kuni üheksakümmend aatomit. The ketid Süsinikuaatomid võivad olla sirgjooneline ja hargnenud ja neil on üksikud kovalentsed sidemed või kaks- või kolmiksidemed. Üle 2500 ühendi sisaldab teadaolevalt ainult süsinikku ja vesinikku (Süsivesinikud).
Orgaaniliste ühendite isomeeria
Anorgaanilistes ühendites tähistab valem tavaliselt ühte ühendit; seega on ainult üks aine valemiga H2SW4. Väävelhappe molekul sisaldab spetsiifilises ja ainulaadses paigas kahte vesinikuaatomit, ühte väävlist ja nelja hapnikust. Orgaanilistes ühendites see on seda juhtub harva. Nii on näiteks kaks ühendit, mis reageerivad valemile C2H6Või etüülalkohol või etanool ja dimetüüleeter.

Mida keerukam molekul, see tähendab, mida suurem on süsinikuaatomite arv, seda suurem on võimalike isomeeride arv.
Orgaaniliste ühendite analüüs
Orgaanilise ühendi analüüs hõlmab: kvalitatiivne analüüs, kvantitatiivne analüüs ja Funktsionaalne analüüs. Eeldades, et ühend on ebapuhtas olekus, on see eelnevalt puhastatud Kristalliseerumine, Destilleerimine, Sublimatsioon, Ekstraheerimine, jne. Puhtuse kriteeriumi saab hinnata selle füüsikaliste konstantide, näiteks sulamistemperatuuri, keemistemperatuuri, tiheduse, lahustuvuse, kristalse vormi, murdumisnäitaja jne põhjal.
The kvalitatiivne analüüs Seda kontrollitakse ühendi moodustavate elementide, eriti süsiniku, vesiniku ja lämmastiku ning mõnikord halogeenide, väävli ja fosfori olemasolu uurimisega.
The kvantitatiivne analüüs Selle teostamisel võetakse aluseks kvalitatiivse analüüsi meetodid. Lähtepunktiks on teatud kogus ainet, mis põleb, süsinikdioksiid kogutakse ja kaalutakse. süsiniku ja vesiniku protsendi arvutamiseks moodustunud süsinik ja veeaur ühend. Kvantitatiivse analüüsi tulemused hõlbustavad standardi arvutamist empiiriline valem, ehkki molekulivalem on leitav alles pärast aine molekulmassi määramist. Kuid probleem pole veel lahendatud, sest sama molekulaarne valem võib vastata erinevatele isomeeridele.
Orgaaniliste ühendite klassifikatsioon
Nende struktuuri järgi jagunevad orgaanilised ühendid ühenditeks alifaatne, aromaatne Y heterotsükliline. Alifaatsed ühendid on seotud metaani CH-ga4, on avatud ahelaga, välja arvatud tsükloparafiinid, ja võlgnevad oma nime asjaolule, et loomsed ja taimsed rasvad kuuluvad sellesse rühma.
The aromaatsed ühendidsuletud ahelaga, tihedalt seotud benseeniga, C6H6ja nad võlgnevad oma nime sellele, et paljudel neist on lõhnavad, meeldivad lõhnad.
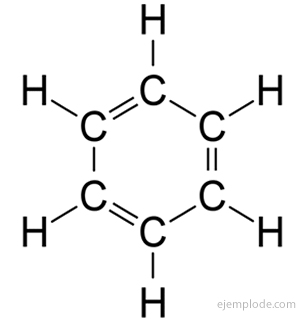
Benseeni rõngas
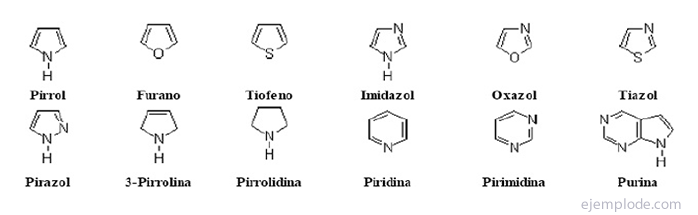
The heterotsüklilised ühendid Need on suletud ahelaga ühendid, mille tsükkel sisaldab muud elementi kui süsinik.
Põhiseaduse tõttu on nad:
Süsivesinikud, mis omakorda on selle linkide tüübi tõttu liigitatud Alkaanid, Alkeenid Y Alküünid. Lisaks kuuluvad sellesse kategooriasse tsükloalkaanid, benseen ja nende derivaadid, mis koosnevad ainult süsinikust ja vesinikust.
Heterotsüklilised ühendid
Halogeenitud derivaadid:R-X
Nitroühendid:R-EI2
Sulfoonhapped:R-SO3H
Nitriilid (OR alküültsüaniidid) ja isonitriilid:R-CN ja R-NC. Nad erinevad selle poolest, kuidas lämmastiku aatom on molekulis seotud.
Alkoholid:R-OH
Fenoolid: Ühendid, mis põhinevad selgrool, mis koosneb benseensüklist koos lisatud hüdroksüülrühmaga.

Eetrid:R-O-R
Merkaptaanid: R-SH
Tioeetrid:R-S-R
Tiohapped:R-COSH
Aldehüüdid:R-CHO
Ketoonid:R-CO-R
Karboksüülhapped:R-COOH
Mine välja:R-COOM (M metalli jaoks)
Estrid: R-COO-R
Anhüdriidid: R-CO-O-OC-R
Aminid:R-NH2, R-NH-R, 2R-N-R
Aldosa tüüpi süsivesikud:-CHOH-CHOH-CHO
Ketoosi tüüpi süsivesikud:-CHOH-CO-CH2Oh
Metallorgaanilised ühendid:R-M-R
Metallalküülhalogeniidid:R-MX (tuntud ka kui Grignardi reaktiivid)



