Reaktiivmaterjalide näide
Keemia / / July 04, 2021
The Reaktiivsed materjalid on need ained, mis mõne muu kokkupuutel kipuvad alustada keemilist reaktsiooni. Selle reaktsiooni lõpus on selle tulemusena teatud kogus erinevaid aineid.
Reaktsioonivõime ainetes
The Reaktsioonivõime on ainete maht suhelda teistega keemilises reaktsioonis. Kõiki selles reaktsioonis osalejaid nimetatakse reaktiivseteks. Kui keemiline nähtus lõpeb, kutsusid erinevad ained Tooted.
Tööstuskeskkonnas kasutatakse reaktiivsust siis, kui soovite toote kogus tagaotsitav. Tööstusettevõtetes tehakse tooraine valimine, mille koostises on sobivad reaktiivid, ja asetage see keemilise reaktsiooni toimimiseks konteineris nimega Reaktor ja veenduge, et oleks olemas ökonoomne protsess ja tõhus.
On aegu, kui reaktsioon see saab olema spontaanneja see viiakse läbi vaevata, lihtsalt reagentide kokkupuutel. Reageerijaid oleks vaja ainult nende lisamise soodustamiseks loksutada.
Muudel juhtudel ei piisa lihtsalt reagentide kontaktist, kuid on vaja tingimusi muuta protsessi lisamine, lisades reaktorile rohkem segamist või lisades kuumutamise või isegi jahutamise, nii et reaktsioon saab alguse ja kulgeb parema kiiruse ja saagisega.
Reagendid hakkavad toodete loomisel kaasa lööma, kuid teevad seda vastavalt proportsioonile mis näitab reaktsiooni väljendavat võrrandit järgmiselt:
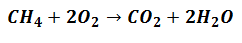
See tähendab, et metaanreagendid (CH4) ja hapnik (O2) segatakse 1 kuni 2 molekuliühiku vahekorras vastavate toodete moodustamiseks.
Kui mõni reagentidest on lisatud vähemalt summa mis on vajalik arvutatud kujul, kutsutakse Reagendi piiramine, sest kui kõik ära kulub, siis reaktsioon lakkab.
Teist reagenti, mis reaktsiooni lõpus on ülejääk, nimetatakse Reaktiivne liigse sisalduse korralja loomulikult tuleb see koos toodetega.
Ainete reaktsioonivõimet saab kasutada paljude keemiliste nähtuste korral, näiteks Oksüdeerumised, kaaliumpermanganaadi puhul; Katalüüsnagu plaatina metallist peene võrgusilma kujul; elementaarsed vahetusednagu tsinkmetalli puhul, mis asendab hapetes vesinikku.
Reaktsioonivõime kui ohtlike materjalide omadus
The Reaktsioonivõime tähistab a riskantne vara kui reaktiivne materjal on juba kasutamata jäätmed, valatakse see kõigepealt anumasse, mis tagab selle püsimise inimesega kokkupuutest eraldatuna. Kui jäätmed on tahked või vedelad, on need tavaliselt paksud plastmahutid, millel on kohustuslikuks tunnuseks kleebis "Reagendi materjali" piktogramm, mis on oranži taustaga pilt ja vastav sümboloogia mustaga. Järgmine pilt näitab erinevat tüüpi reaktsioonivõime signaalide mitmekesisust.

Reaktsioonivõime on üks omadusi Ohtlike jäätmete CRETIB: Sööbiv, reaktiivne, plahvatusohtlik, mürgine, tuleohtlik ja bioloogiliselt nakkav. Tegelikult on see kõige esinduslikum, sest kõik muud omadused on seotud reaktsioonivõimega.
Väga sagedane juhtum, kus nende materjalide oht kokku puutub, on nende lekkimine. Näiteks kui tekib väävelhappe leke ja see lekib väga suurele alale, tuleks töötajad, kellel puudub olukorra kontrollimiseks vajalik väljaõpe. Sellesse koolitatud inimesed peavad sekkuma.
Ohtliku olukorra kõrvaldamise protseduur algab kohale minekust, kandes vastavaid isikukaitsevahendeid. Tehke kindlaks ja isoleerige reaktiivmaterjali lekkeala ning see hakkab reageerima selle reaktsioonivõimele mõne teise keemiliselt vastupidise liigiga. Sel juhul toimib väävelhape happena. Seda reaktsioonivõimet on võimalik kustutada ainult selliste liikidega nagu naatriumhüdroksiid, mis on üks võimsamaid aluseid.
Happe ja aluse vahelist reaktsiooni nimetatakse neutraliseerimiseks. Selle nähtuse abil suunatakse lekkes oleva väävelhappe reaktsioonivõime naatriumhüdroksiidi aktiivsusele.
Tuleb aeg, mil naatriumhüdroksiid, samuti reaktiivne materjal, lõpetab väävelhappe ohtlikkuse. Kui reaktsioon on lõppenud, jääb ainult toodete lahjendamine rikkaliku veevooluga.

Reaktiivmaterjalide näited
- Naatriumhüdroksiid
- Kaltsiumhüdroksiid
- Magneesiumhüdroksiid
- Väävelhape
- Vesinikkloriidhape
- Lämmastikhape
- Vesiniksulfiid
- Kaaliumnitraat
- Naatriumvesinikkarbonaat
- Süsinikdioksiid
- Vääveldioksiid
- Vääveltrioksiid
- Gaasiline vesinik
- Gaasiline hapnik
- Kloorgaas
- Gaasiline broom
- Metalliline liitium
- Metalliline naatrium
- Metalliline tseesium
- Metalliline magneesium
- Ammooniumnitraat
- Naatriumkloriid
- Kaaliumkloriid
- Kaltsiumkloriid
- Kaaliumpermanganaat
- Naatriumpermanganaat
- Metalliline plaatina
- Metallist tsink
- Kaltsiumkarbiid
- Atsetüleen
- Metaan
- Etaan
- Propaan
- Butaan