Ideaalsete ja tõeliste gaaside näide
Füüsika / / July 04, 2021
A Ideaalne gaas on see, mille omadused meeldivad Rõhk, temperatuur ja maht kaetud, nad hoiavad alati proportsioon või pidev suhe nende vahel. Teisisõnu järgib tema käitumine ideaalgaasiseadust, mis on esitatud järgmiselt:
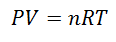
Selle valemi saavutamiseks alustame La-st Gaasilise riigi üldine seadus, mis kirjeldab, et gaasi omaduste vahel on protsessi käigus pidevalt seos. Need omadused, millest räägitakse, on Rõhk süsteemis, kus gaas asub, Köide mis hõivab gaasi ja Temperatuur gaasi.
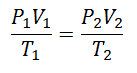
Varem või hiljem otsustati moodustada lihtsam väljend, andes püsivusele selle väljendiga tähe:
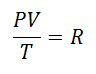
Seda kutsuti Universaalne gaasikonstant teguril R, ja selle väärtus on järgmine:
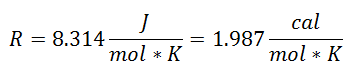
Ja kuna gaasi iga mooli kohta kehtib universaalne gaasikonstant, siis Gaasimoolide arv ühe tegurina katta kogu protsessis kogu süsteemis sisalduv aine. Lõplik võrrand on meil juba sellisel kujul:
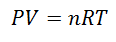
Ülaltoodud võrrand on Ideaalne gaasiseadus, ja see kehtib gaaside kohta, mille temperatuur on mõõduka ja kõrge vahel. Seega saab arvutada mis tahes muutuja, kui teised on määratud.
Erinevus ideaalsete gaaside ja tegelike gaaside vahel
See ideaalne gaasiseadus ei kehti gaaside jaoks, mis on madal temperatuur või lähedal punktile, kus need muutuvad vedelaks.
Madalate temperatuuride tagajärjeks on a vähem osakeste liikumist gaasi ja need settivad rohkem, hõivates erineva mahu kui siis, kui need olid täielikult hajutatud.
Lisaks teostaksid nad samal põhjusel a Ebaühtlane rõhk kogu süsteemis. Proportsionaalsus hakkab ebaõnnestuma ja valem ei ole arvutuste jaoks sama kehtiv.
Sellisel juhul tuleks kasutada reaalgaaside võrrandeid.
A Päris gaas on see, mille omadused nad ei järgi täpselt suheldes nagu ideaalgaasiseaduses, nii on ka nende omaduste arvutamise viis muudetud.
Reaalgaaside olekuvõrrandid
1. - viiruse võrrand:
Gaasi eest, mis jääb Püsiv temperatuur, rõhu ja mahu või rõhu ja erimahu (gaasi iga massiühiku hõivatud maht) suhe.
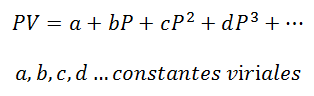
Viiruskonstandid on iga gaasi omadused, mille konkreetsed väärtused sõltuvad temperatuurist.
Ainult rõhu ja mahu arvutusi saab teha; Temperatuur määratakse eelnevalt protsessi jälgides. Nende arvutuste jaoks kustutatakse viirusvõrrandi muutujad:
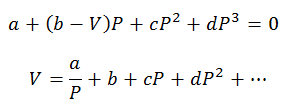
Viiruskonstandid võrrandite lahendamiseks saadakse spetsiaalsetest tabelitest.
2.- võrrandVan der Waals:
Van der Waalsi võrrand on veel üks väljend, mida kasutatakse reaalgaasi omaduste arvutamiseks, ja nagu viirvõrrand, nõuab see ka selle konstandi:

Konstante küsitakse ka tabelites.
3.- võrrandRedli edasich-Kwong:
See võrrand töötab väga hästi gaaside arvutamiseks peaaegu igal temperatuuril ja keskmisel rõhul, kuid mitte liiga kõrge, näiteks sadade atmosfääride korral.
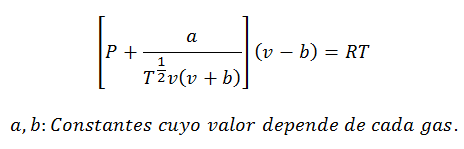
Konstante küsitakse ka tabelites.
Arvutuste tegemiseks saate tühjendada rõhu, temperatuuri ja helitugevuse. Kliirensid jäävad:
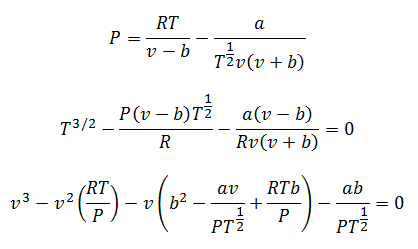
4.-Bertheloti võrrand:
Selle võrrandiga on võimalik arvutada ükskõik milline muutuja. Ainult sellel on kaks erinevat režiimi: madala rõhu ja kõrge rõhu jaoks.
Madalal rõhul:

Kõrge rõhu korral:
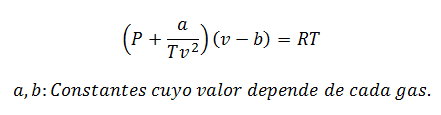
Konstante küsitakse ka tabelites.
5.-tihendusteguri võrrand
See võrrand on ideaalse gaasiseaduse lihtsam variant; lisatakse ainult tegur "z", mida nimetatakse kokkusurutavusteguriks. See tegur saadakse üldise kokkusurutavusteguri graafikult, sõltuvalt temperatuurist, rõhust või konkreetsest mahust, olenevalt sellest, mis on saadaval.
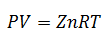
Ideaalsete ja tõeliste gaaside näited
Ideaalse või tegelase tegelasena See sõltub rõhu tingimustest, temperatuurist, milles gaas on, Piiratud loetelu koostamine ei ole võimalik, seetõttu esitatakse loetelu gaasidest, mida võib muidugi leida ideaalsusest ja tegelikkusest.
- Ammoniaak
- Külmaagens R134 (DiFluoroDiCloro Ethane)
- Süsinikdioksiid
- Vingugaas
- Hapnik
- Lämmastik
- Vesinik
- Lämmastikdioksiid
- Dinitrogeentrioksiid
- Dinitrogeenpentoksiid
- Dinitrogen Heptoxide
- Vääveldioksiid
- Vääveltrioksiid
- Kloor
- Heelium
- Neoon
- Argoon
- Krüpton
- Ksenoon
- Metaan
- Etaan
- Propaan
- Butaan

