Kuinka hapot, emäkset ja suolat muodostuvat?
Sekalaista / / July 04, 2021
On useita teorioita määritellä happoja ja emäkset, joiden joukossa ovat Arrhenius, Brönsted-Lowry ja Lewis.
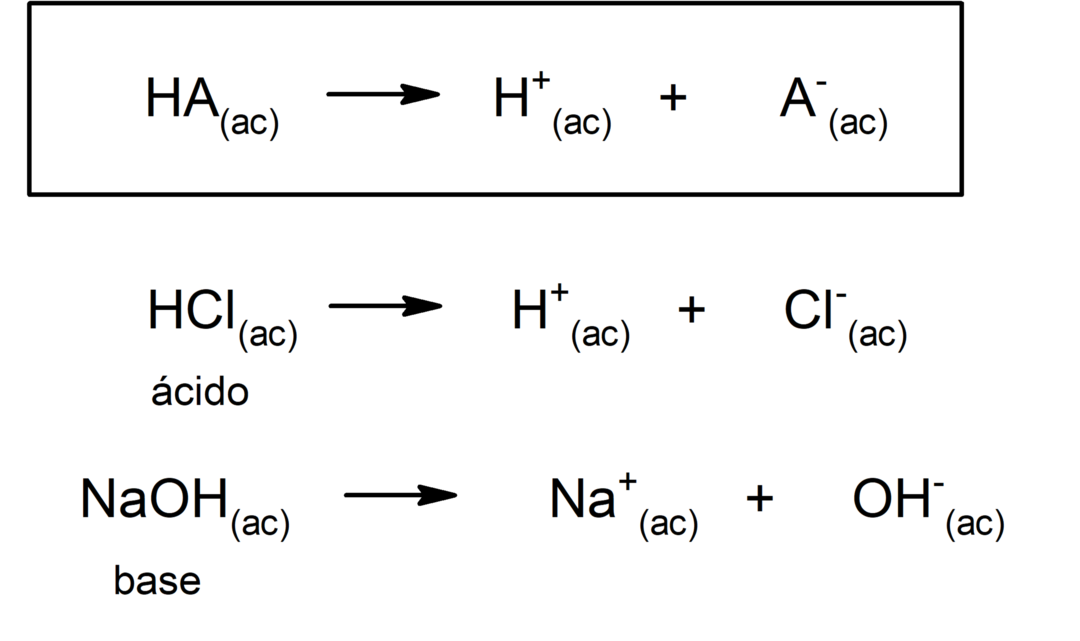
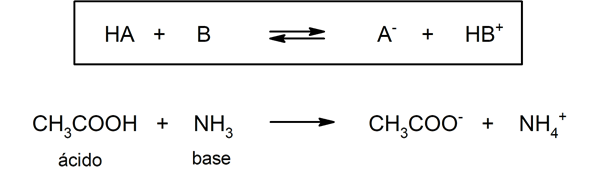
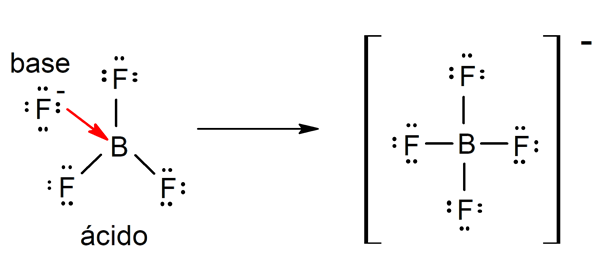
Tyyppi hapot hapot muodostuvat yleensä reaktio ei-metallisen oksidin ja veden välillä, kun taas tyypin hapot hydridit muodostuvat yhdistelmällä a ei-metalliset vedyn kanssa vesiliuoksessa. Esimerkiksi:rikkihappo (H2SW4) se on happohappo ja kloorivetyhappo (HCl(ac)) se on hydrohappo.
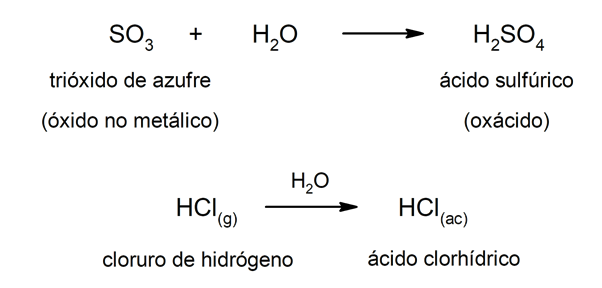
Toisaalta emäkset voivat muodostua a metallioksidi Ja vesi. Esimerkiksi: magnesiumhydroksidi (Mg (OH)2).
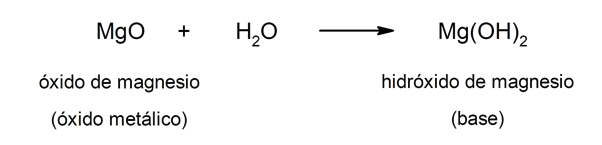
Happojen ja emästen yleiset ominaisuudet
Hapot ovat yleensä hapan ja syövyttävä. Pohjat ovat myös syövyttävä, katkeran maun, syövyttävä joutuessaan kosketuksiin ihon kanssa ja kosketus saippualla. Toisaalta happoliuoksilla on a pH alle 7, kun taas emäksisten liuosten pH on yli 7.
Happo- ja emäslujuus
hapon taipumus pH: n dissosiaatioon ja laskemiseen viitataan usein "happolujuudella". Happo on vahva, kun se voi dissosioitua kokonaan vesiliuoksessa, ja on heikko, kun sen dissosiaatio tapahtuu osittain. Esimerkkejä vahvista hapoista ovat perkloori (HClO
4), rikkihappo (H2SW4), vesijodinen (HI), bromivetyhappo (HBr), kloorivetyhappo (HCl) ja typpi (HNO)3). Toisaalta etikkahappo (CH3COOH), sitrushedelmät (C6H8TAI7) ja bentsoehappo (C6H5COOH) ovat heikkoja.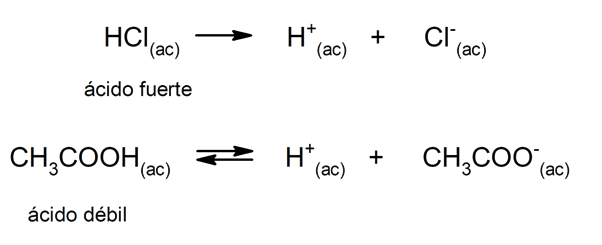
Vastaavasti niitä voidaan pitää vahvat emäkset ne, jotka dissosioituvat kokonaan vesiliuoksessa, ja heikot, kun niiden dissosiaatio tapahtuu osittain. Esimerkkejä vahvista emäksistä ovat kaliumhydroksidi (KOH), natrium (NaOH), litium (LiOH) ja magnesium (Mg (OH)2). Toisaalta ammoniakki (NH3) on heikko perusta.
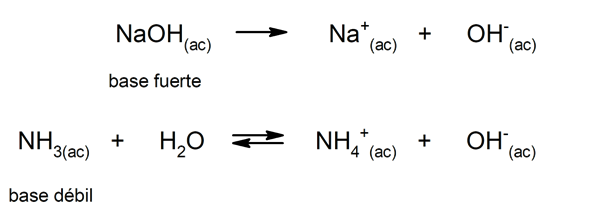
Kuinka suolat muodostuvat?
menet ulos ovat monimutkaisen vaihtelevia, luonteeltaan runsaita ja yleensä muodostuneita ionisia yhdisteitä yhdistämällä happoja emästen kanssa neutralointireaktiossa, joka tuottaa Vesi. Ne voivat muodostua myös metallin ja hapon, metallin ja ei-metallin välisen reaktion tai erilaisten suolojen reaktion seurauksena.
Suolat voidaan luokitella:
Jakelu ja merkitys
Hapot ovat erittäin tärkeitä molemmissa maissa ala kuin luonto. Esimerkiksi suolahappo on osa ruoansulatuskanavaa ja on välttämätöntä, jotta voimme hajottaa ravintoyhdisteet ruokaa. Deoksiribonukleiinihappo, joka tunnetaan paremmin nimellä DNA, muodostaa kromosomit, missä koodataan niiden koodaamiseen tarvittava geneettinen informaatio. elävät olennot lisääntyä ja kehittyä. Boorihappo on merkittävä komponentti lasiteollisuudessa.
kalsiumkarbonaatti Se on erittäin runsas suola erityyppisissä kalkkikivikivissä. Suurella osuudella lämpötiloissa (900 ° C) kalsiumkarbonaatista, kalsiumoksidista tai sammuttamattomasta kalkista saadaan. Veden lisääminen kalkkiin tuottaa emäksenä kalsiumhydroksidia, jota kutsutaan sammutetuksi kalkiksi. Nämä materiaaleja niitä käytetään rakentamisessa.
Seuraa:


