20 esimerkkiä happosuoloista
Sekalaista / / July 04, 2021
vuonna epäorgaaninen kemia suoloja kutsutaan yhdisteiksi, jotka saadaan, kun a happo sen vetyatomit korvataan metallikationeilla (tosin joskus ei-metallisilla kationeilla, esimerkiksi ammoniumkationilla, NH4+). Erityistapauksessa happosuolat, hapon vedyt ovat osittain substituoituja, eli ainakin yksi substituoimaton vety jää osaksi suolaa. Sillä, että ne erotetaan neutraalit suolat, jossa hapon vedyt ovat täysin substituoituja.
menet ulos muodostuvat yleensä a happo ja a hydroksidi (pohja). Näissä reaktioissa emäs menettää normaalisti hydroksyyliryhmänsä (-OH) ja happo menettää ne. atomeja vety (H) muodostaen neutraalin suolan; mutta jos kyseinen happo säilyttää ainakin yhden vetyatomistaan muuttamalla reaktion sähkövarausta, saadaan happosuola tai hydrattu suola.
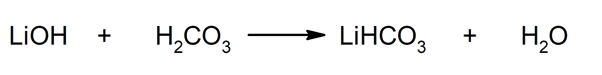
Siten esimerkiksi litiumbikarbonaatti ja vesi saadaan litiumhydroksidin ja hiilihapon välisestä reaktiosta:
Happosuolojen nimikkeistö
Happosuolat voidaan nimetä kolme tyyppiä yleisin nimikkeistö:
Esimerkkejä happosuoloista
- Natriumbikarbonaatti (NaHCO3). Kutsutaan myös natriumvetykarbonaatiksi (IV), se on valkoista kiteistä kiinteää ainetta, joka liukenee veteen ja jota löytyy luonnossa tilassa mineraali tai se voidaan valmistaa laboratoriossa. Se on yksi tunnetuimmista happosuoloista ja sitä käytetään laajalti makeisten, farmakologian tai jogurtin valmistuksessa.
- Litiumbikarbonaatti (LiHCO3). Tätä happosuolaa on käytetty CO: n sieppausaineena2 tilanteissa, joissa tällainen kaasu ei ole toivottavaa, kuten Pohjois-Amerikan Apollo-avaruusoperaatioissa.
- Kaliumdivetyfosfaatti (KH2PO4). Se on kiteinen kiinteä aine, hajuton, veteen liukeneva, jota käytetään laajalti eri teollisuudenaloilla, kuten esimerkiksi hiivan ruokaa, kelaatinmuodostaja, ravintoaineiden vahvistaja ja avustaja käymisprosesseissa
- Natriumbisulfaatti (NaHSO4). Se on happosuola, joka muodostuu rikkihapon neutraloinnilla. Sitä käytetään laajasti teollisesti metallien ja puhdistusaineiden jalostuksessa. Vaikka se on erittäin myrkyllistä joillekin piikkinahkaisille, sitä käytetään lisäaineena lemmikkieläinten ruoassa ja korujen valmistuksessa.
- Natriumvetysulfidi (NaHS). Se on vaarallinen yhdiste käsiteltäväksi, koska se on erittäin syövyttävää ja myrkyllistä. Se voi aiheuttaa vakavia palovammoja iholle ja silmävaurioita, koska se on myös palavaa.
- Kalsiumvetyfosfaatti (CaHPO4). Sitä käytetään ravintolisänä vuonna viljat naudoille. Se on veteen liukenematon kiinteä aine, joka kiteytyy hydratoituna kuluttamalla kaksi molekyylejä vedestä.
- Ammoniumvetykarbonaatti ([NH4] HCO3). Tunnetaan myös nimellä "ammoniumbikarbonaatti", ja sitä käytetään elintarviketeollisuudessa hiivana kemikaali, vaikka sillä on haitta, että se vangitsee ammoniakin ja antaa ruoalle huonon maun, jos sitä käytetään ylimääräinen. Sitä käytetään myös sammuttimissa, pigmenttien valmistuksessa ja kumin laajentamiseen.
- Bari-bikarbonaattitai (Ba [HCO3]2). Se on happosuola, joka kuumennettaessa voi kääntää tuotantoreaktionsa ja on erittäin epävakaa paitsi liuoksessa. Sitä käytetään laajalti keramiikkateollisuudessa.
- Natriumbisulfiitti (NaHSO3). Tämä suola on erittäin epävakaa ja hapen läsnä ollessa se muuttuu natriumsulfaatiksi (Na2SW4), minkä vuoksi sitä käytetään elintarviketeollisuudessa elintarvikkeiden säilöntäaineena ja kuivausaineena. Se on äärimmäisen pelkistävä aine, jota ihminen käyttää yleisesti ja jota käytetään myös värien kiinnittämiseen.
- Kalsiumsitraatti (AC3[C6H5TAI7]2). Yleisesti tunnettu karvas suola, sitä käytetään ruoan säilöntäaineena ja ravintolisänä, kun se on kytketty aminohappoon lysiini. Se on valkoinen, hajuton, kiteinen jauhe.
- Monokalsiumfosfaatti (Ca [H2PO4]2). Se on väritön kiinteä aine, joka saadaan kalsiumhydroksidin ja fosforihapon reaktiosta, jota käytetään laajalti hapatusaineena tai lannoitteena maataloustyössä.
- Dikalsiumfosfaatti (CaHPO4). Se tunnetaan myös nimellä kalsiumvetyhydrofosfaatti, sillä on kolme erilaista kiteistä muotoa, joita käytetään lisäaineena elintarvikkeissa ja jota esiintyy hammastahnoissa. Lisäksi se muodostuu luonnostaan munuaiskivissä ja ns. ”Munuaiskivessä”.
- Monomagnesiumfosfaatti (MgH4P2TAI8). Se on valkoinen, kiteinen ja hajuton suola, osittain vesiliukoinen. Sitä käytetään elintarvikkeiden säilyttämisessä, happamuusaineena, happamuuden korjaajana tai aineena hoidettaessa jauhot.
- Natriumdiasetaatti (NaH [C2H3TAI2]2). Tätä suolaa käytetään aromiaineena ja säilöntäaineena aterioissa, mikä estää tai viivästyttää sen ulkonäköä sienet ja mykobakteerit, sekä tyhjiöpakattuissa tuotteissa kuten lihatuotteissa että jauhoteollisuudessa.
- Kalsiumbikarbonaatti (Ca [HCO3]2). Se on hydrattu suola, joka on peräisin kalsiumkarbonaatista, jota on mineraaleissa, kuten kalkkikivessä, marmorissa ja muissa. Tähän reaktioon liittyy veden ja CO: n läsnäolo2, joten se voi esiintyä spontaanisti luolissa ja kalsiumpitoisissa luolissa.
- Rubidiumhappofluoridi (RbHF). Tämä suola saadaan fluorivetyhapon (vety ja fluori) ja alkalimetallin rubidiumin reaktiossa. Tuloksena on myrkyllinen ja syövyttävä yhdiste, jota on käsiteltävä varoen.
- Monoammoniumfosfaatti ([NH4] H2PO4). Se on vesiliukoinen suola, joka tuotetaan ammoniakin ja fosforihapon reaktiolla. Sitä käytetään yleensä lannoitteena, koska se antaa maaperälle ravinteita typen ja fosforin kasvien kasvun kannalta. Se on myös osa ABC-jauhetta palosammuttimissa.
- Sinkkivety ortoboraatti (Zn [HBO3]). Se on suola, jota käytetään antiseptisenä aineena ja lisäaineena keramiikan valmistuksessa.
- Mononatriumfosfaatti (Ei2PO4). Sitä käytetään enimmäkseen laboratorioissa "puskurina" tai puskuriliuoksena, joka estää äkilliset muutokset liuoksen pH: ssa.
- Kaliumvetyftalaatti (KHP). Sitä kutsutaan myös "kaliumhappoftalaatiksi", se on kiinteä ja stabiili suola tavallisessa ilmassa, minkä vuoksi sitä käytetään usein ensisijaisena standardina pH. Se on hyödyllinen myös puskurointiaineena kemialliset reaktiot.
Seuraa:
