Määritelmä molekyyligeometria
Sekalaista / / January 11, 2022
Käsitteellinen määritelmä
Se on molekyylin rakenne, joka määrittää sen muodostavien atomien kolmiulotteisen järjestelyn avaruudessa.

Kemian insinööri
Molekyyligeometriat määritellään tällä hetkellä sen perusteella Teoria Valencia-kerroksen elektronisten parien hylkiminen (TRPECV). Tämä teoria mahdollistaa käyttäytymisen ennustamisen kemiallinen aineiden (erityisesti kovalenttisten) ja auttaa ymmärtämään jakelu elektroniikka, mikä johtaa geometria -lta molekyyli. Tämä puolestaan antaa meille mahdollisuuden ymmärtää monia ominaisuuksia, joita aineet saavat.
Tämä teoria perustuu useisiin peruspilareihin, joita tarkastelemme ja yritämme sitten ymmärtää niiden perusteet sovellus harjoitella. Ensinnäkin sitoutuneita ja sitoutumattomia (valenssi)elektroneja pidetään elektronien merenä, joka niillä on samantyyppinen varaus, ne hylkivät toisiaan, joten ne sijaitsevat aina niin kaukana keskusatomista. molekyyli.
Toiseksi tämä elektronien "meri" tai "elektroninen pilvi" muodostaa alueita, joilla on korkea elektronitiheys, jotka muodostuvat sidoksista, joissa elektronit ovat yhteisiä tai elektronipareja, joita ei jaeta. Muodostuvat sidokset voivat puolestaan olla yksi-, kaksois- tai jopa kolminkertaisia.
Lopuksi varten päättää molekyyligeometria, on erittäin hyödyllistä saada Lewis-rakenne, jossa lasketaan elektronitiheyksien määrä keskusatomin ympärillä ja tämä antaa osoitus sen geometrian nimestä ja muodosta, jonka molekyyli ottaa kolmiulotteisesti.
On huomattava, että nämä tiheydet sijoitetaan mahdollisimman kauas toisistaan, jotta ne saavuttaisivat vakaimman rakenteen ja missä on vähemmän hylkimistä. Näin ensin tunnistetaan elektroninen geometria ja sitten molekyyligeometria.
Kuusi tiheystasoa
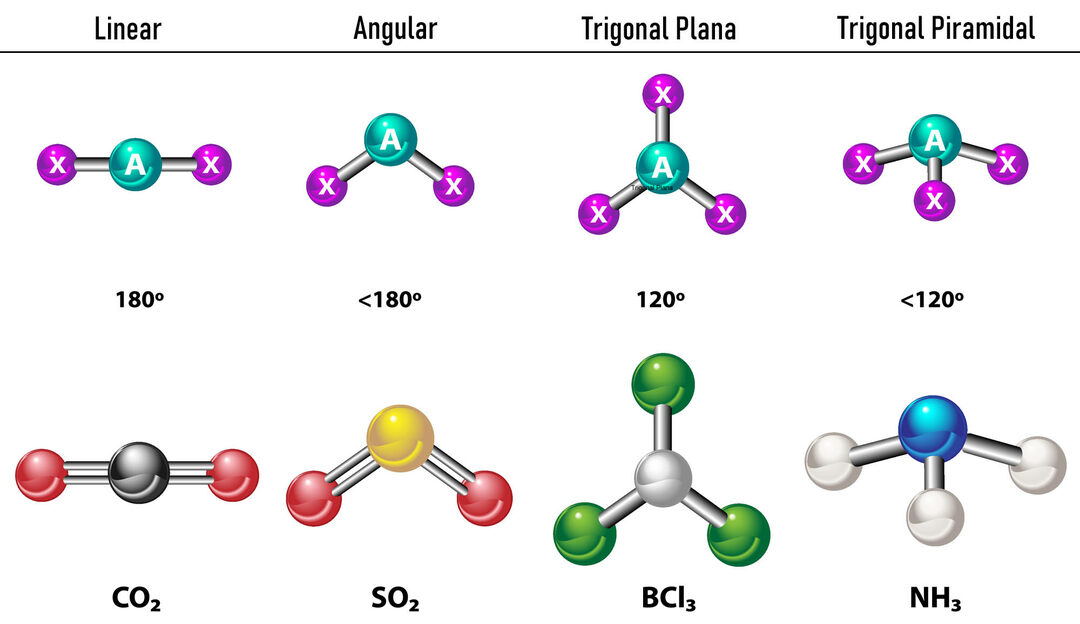
Siinä tapauksessa, että keskusatomin ympärillä on kaksi elektronitiheyttä, sidokset sijaitsevat niin kaukana toisistaan niiden välillä, eli 180º toisistaan, ja siksi niiden elektroninen geometria on lineaarinen ja molekyylisesti myös lineaarinen.
Siinä tapauksessa, että keskusatomin ympärillä on kolme elektronitiheyttä, on kaksi vaihtoehtoa: kolme sidosta tai kaksi sidosta ja yksi sitoutumaton pari. Jos sidoksia on kolme, elektroninen geometria on Trigonaalinen tasainen, jossa sidosten välinen kulma on 120º, ja molekyyligeometria saa saman nimen. Jos nyt on sitoutumaton pari, ne hylkivät toisiaan enemmän intensiteetti että sidotut varaukset pyrkivät siksi puristamaan sidoskulmia. Vapaan parin ja kunkin sidoksen välinen kulma on 120º ja elektroninen geometria on kolmiotaso, kun taas molekyyligeometria on kulma.
Siinä tapauksessa, että keskusatomin ympärillä on neljä elektronitiheyttä, elektroniikkageometria on tetraedrinen. Jos kaikki neljä elektroniparia on sidottu, niiden molekyyligeometria on nimensä mukainen niiden elektronisen geometrian kanssa ja sidoskulma on 109,5º. Nyt, jos yksi pareista on vapaa, sidoskulma pienenee (107º) ja molekyyligeometria on tyyppiä Trigonaalinen pyramidi. Lopuksi, jos kaksi on vapaita pareja ja kaksi on sidottu, sidoskulma on 104,5º, kun taas molekyyligeometria on ns. Kulmikas.
Kun elektronitiheydet keskusatomin ympärillä ovat viisi, sitä kutsutaan a Trigonaalinen bipyramidi sen elektroninen geometria. Jos kaikki kuormat liittyvät toisiinsa, ekvatoriaalisesti sijaitsevien linkkien välillä on 120ºC kulmat ja aksiaalisten ja ekvatoriaalisten linkkien välillä 90º. Nykyään molekyyligeometriaa kutsutaan myös trigonaaliksi bipyramidiksi, kun taas molekyyligeometria on vääristynyt, koska sillä on neljä yhdistettyä paria ja yksi vapaa pari, jolloin muodostuu hyvin tunnettu "rokkari”, Siellä on sen hankkima nimi Vääristynyt tetraedri. Jos taas kaksi viidestä elektroniparista on vapaita ja kolme niistä on sidottu, sillä on "T"-muotoinen geometria ja sen nimi johtuu juuri sen rakenteesta. Lopuksi, jos se on päinvastainen, kolme vapaata paria ja kaksi sitoutunutta varausta, molekyyligeometria on lineaarinen.
Lopuksi keskusatomin ympärillä on kuusi elektronitiheyttä ja muodostuu oktaedri, josta se on saanut nimensä elektroniikkageometriassa. Vastaavasti molekyyligeometria nimetään, jos kaikki sen parit ovat linkitettyinä. Jos sinulla on viisi yhdistettyä paria ja yksi vapaa pari, molekyyligeometria on Square Base Pyramid. Jos sinulla on neljä sidottua paria ja kaksi vapaata paria, molekyyligeometria on Neliön tasainen.
Kuva: Sweet Nature
Molekyyligeometrian aiheita


