Esimerkkejä endotermisistä reaktioista
Esimerkkejä / / November 09, 2023
A endoterminen reaktio Se on reaktio, joka absorboi energiaa väliaineesta lämmön muodossa. Näissä reaktioissa, jotta lähtöaineet muuttuvat tuotteiksi, on välttämätöntä, että ne absorboivat lämpöä, mikä saa tuotteissa olemaan enemmän energiaa kuin niitä synnyttäneillä lähtöaineilla. Joitakin esimerkkejä endotermisistä reaktioista ovat: fotosynteesi ja vesielektrolyysi.
- Katso myös: Kemialliset reaktiot
Esimerkkejä endotermisistä reaktioista jokapäiväisessä elämässä
Jotkut tärkeimmistä endotermisistä reaktioista ovat:
Otsonin tuotanto ilmakehässä. Otsonia syntyy ilmakehässä, kun molekyylihappi (O2) absorboi ultraviolettisäteilyä ja hajoaa. Sitten happiatomi (O) voi olla vuorovaikutuksessa toisen happimolekyylin (O2) ja muodostavat otsonia (O3).

Veden elektrolyysi. Se on prosessi, jolla sitä sovelletaan Sähkövoima veteen erottaakseen sen kahdeksi komponentiksi, vedyksi (H) ja hapeksi (O).
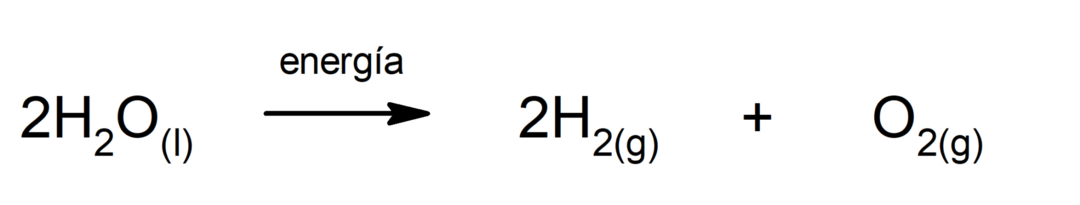
Fotosynteesi. Se on kemiallinen reaktio, jolla imeytyy aurinkoenergia, hiilidioksidi (CO2) muuttuu glukoosiksi. Tämä reaktio on kasvien pääasiallinen ravintoreitti.
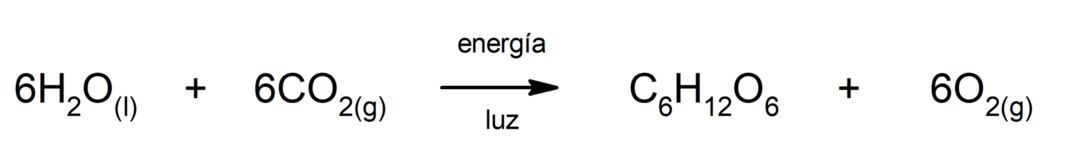
Rauta(II)sulfidin tuotanto. Jotta rikin ja raudan välinen reaktio tapahtuisi, on välttämätöntä tuottaa energiaa lämmön muodossa.
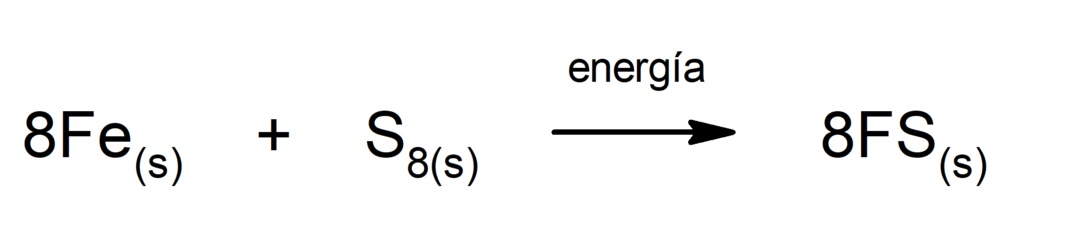
Hiilidioksidin hajoaminen (CO2). CO: n hajoaminen2 Korkeissa lämpötiloissa se tuottaa hiilimonoksidia (CO) ja happea (O2).
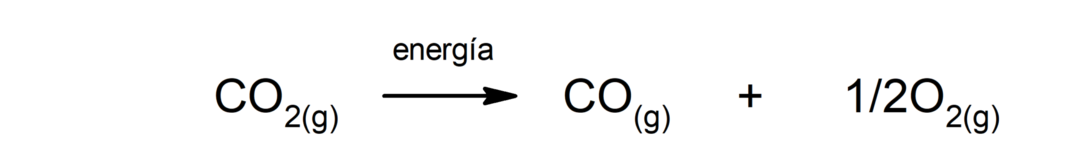
Kalsiumkarbonaatin hajoaminen (CaCO3). Kalsiumkarbonaatti hajoaa lämmön imeytyessä muodostaen kalsiumoksidia (CaO) ja hiilidioksidia (CO)2).
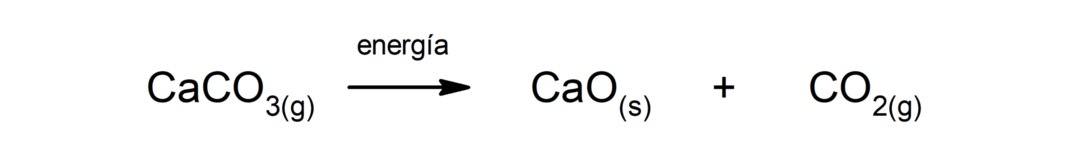
Ero endotermisen ja eksotermisen reaktion välillä
Suurin ero endotermisten ja eksotermisten reaktioiden välillä on, että endotermiset reaktiot absorboivat lämpöä, kun taas eksotermiset reaktiot vapauttavat lämpöä.
Lisäksi endotermisille reaktioille on ominaista entalpian nousu, kun taas eksotermisille reaktioille liittyy entalpian lasku.
Entalpia on termodynaaminen suure, joka määrittää lämpöenergian virtauksen vakiopaineessa kemiallisen reaktion aikana. Sitä edustaa kirjain H, ja sen vaihtelu on yksi tärkeimmistä indikaattoreista määrittämään, onko kemiallinen reaktio endoterminen vai eksoterminen.
- Jos kemiallisen reaktion entalpian muutos on suurempi kuin nolla (ΔH > 0) on endoterminen.
- Jos kemiallisen reaktion entalpian muutos on pienempi kuin nolla (ΔH < 0) on eksoterminen.
Seuraa:
- Fysikaaliset ja kemialliset ilmiöt
- Kemia jokapäiväisessä elämässä
- Kemia jokapäiväisessä elämässä
- Orgaaninen ja epäorgaaninen kemia
Viitteet
- Soto-Córdoba, S. (2016). Endotermiset reaktiot. Tekninen arkisto Costa Rican teknologinen instituutti.
- Corominas, J. (2017). Arjen kemialliset reaktiot. Alembic, (90), 8-26.
- Sánchez, M. T. M. & Sánchez, M. M. (2002). Endotermisten reaktioiden kokeellinen tutkimus ESO: n opiskelijoille. Annals of Chemistry of RSEQ, (4), 36-39.

