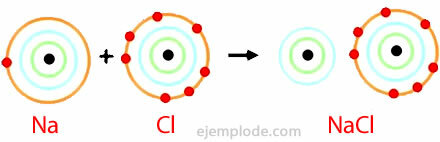
Ionic Bond -esimerkki
Kemia / / July 04, 2021
Ionisidoksen antaa kationin ja anionin läsnäolo, kemialliset lajit, joilla on vastakkaisten merkkien sähkövarat. Se määritellään sähköstaattisena voimana, joka sitoo ioniyhdisteen ioneja.
Alhaisen ionisaatioenergian omaavien elementtien atomeilla on taipumus muodostaa kationeja. Sitä vastoin ne, joilla on korkea elektroniaffiniteetti, muodostavat yleensä anioneja.
Alkali- ja maa-alkalimetallit muodostavat todennäköisemmin kationeja ioniyhdisteissä, ja halogeenit ja happi muodostavat todennäköisimmin anioneja. Tämän seurauksena suuren valikoiman ioniyhdisteiden koostumus johtuu IA- tai IIA-ryhmän metallin ja halogeenin tai hapen yhdistelmästä.
Esimerkiksi litiumin ja fluorin välinen reaktio tuottaa litiumfluoridia, myrkyllistä valkoista jauhetta, jota käytetään juotteen sulamispisteen alentamiseen ja keramiikan valmistukseen. Litiumin elektronikonfiguraatio on 1 s2, 2s1, ja fluori on 1s2, 2s2, 2 s5. Kun nämä atomit joutuvat kosketuksiin, valenssielektroni 2s1 Litium siirretään fluoriatomiin.
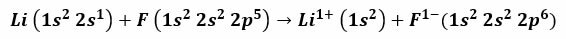
On kelvollista olettaa, että menettely alkaa litiumelektronin irtoamisella, ionisoimalla tämä positiivisen 1+ valenssin saavuttamiseksi. Se jatkuu fluorin vastaanottaessa tämän elektronin, mikä antaa sille negatiivisen varauksen. Loppujen lopuksi ionisidoksen muodostuminen tapahtuu sähköstaattisen vetovoiman avulla. Litiumfluoridiyhdiste on sähköisesti neutraali.
Monet yleiset reaktiot johtavat ionisidosten muodostumiseen. Esimerkiksi kalsiumin palaminen hapessa tuottaa kalsiumoksidia:
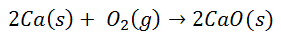
Diatominen happimolekyyli erottuu kahdeksi yksittäiseksi atomiksi. Sitten tapahtuu kahden elektronin siirtyminen kalsiumatomista kullekin happiatomille. Molemmilla on sitten vastaavat varauksensa: kalsium 2+ kullekin atomille ja happi 2 kullekin atomille. Lopullisen sidoksen jälkeen kalsiumoksidimolekyyli on sähköisesti neutraali.
Ioniyhdisteiden ristikkoenergia
Elementtien ionisaatioenergia- ja elektroni-affiniteettiarvoilla voidaan ennustaa mitä alkuaineet muodostavat ionisia yhdisteitä, mutta on myös tarpeen arvioida tämäntyyppisten stabiliteettien stabiilisuus yhdisteet.
Ionisointienergia ja elektroni-affiniteetti määritellään prosesseille, jotka tapahtuvat kaasufaasissa, vaikka kaikki ioniset yhdisteet ovat kiinteitä 1 paineilmakehässä ja 25 ° C: ssa. Kiinteä tila on hyvin erilainen tila, koska kutakin kationia ympäröi tietty määrä anioneja ja päinvastoin. Näin ollen kiinteän ionisen yhdisteen kokonaisstabiilisuus riippuu kaikkien ionien vuorovaikutuksesta eikä vain kationin ja anionin vuorovaikutuksesta.
Kvantitatiivinen mitta minkä tahansa ionisen kiinteän aineen stabiilisuudesta on sen ristikkoenergia, joka määritellään seuraavasti: Energia, joka tarvitaan kiinteän ionisen yhdisteen moolin täydelliseen erottamiseen sen ioneiksi kaasumaisessa tilassa.
Born-Haber-sykli hilaenergian määrittämiseksi
Säleenergiaa ei ole mahdollista mitata suoraan. Kuitenkin, jos ionisen yhdisteen rakenne ja koostumus tiedetään, on mahdollista laskea sen hilan energia soveltamalla Coulombin lakia, joka toteaa, että kahden ionin välinen potentiaalinen energia on suoraan verrannollinen niiden varausten tuloon ja kääntäen verrannollinen niiden väliseen etäisyyteen. Pysähtyä.
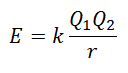
Koska kationin varaus on positiivinen ja anionin negatiivinen, tuote antaa negatiivisen tuloksen energiassa. Tämä edustaa eksotermistä reaktiota. Näin ollen prosessin kääntämiseksi on toimitettava energiaa.
Hilaenergian määrittäminen epäsuorasti on myös mahdollista, jos oletetaan, että ioninen yhdiste muodostuu useissa vaiheissa. Tämä menettely tunnetaan nimellä Born-Haber-sykli, joka yhdistää ioniyhdisteiden hilaenergiat ionisaatioenergiaan, elektroniseen affiniteettiin ja muihin atomi- ja molekyyliominaisuuksiin. Tämä menetelmä perustuu Hessin lakiin kemiallisten reaktioiden algebrallisesta summasta, ja sen ovat kehittäneet Max Born ja Fritz Haber. Born-Haber-sykli määrittelee eri vaiheet, jotka edeltävät ionisen kiinteän aineen muodostumista.

Natriumkloridia
Natriumkloridi on ioninen yhdiste, jonka sulamispiste on 801 ° C, joka johtaa sähköä sulassa tilassa ja vesiliuoksessa. Kivisuola on yksi natriumkloridin lähteistä, ja sitä löytyy maanalaisista kerrostumista, jotka ovat usein useita satoja metrejä. Natriumkloridia saadaan myös merivedestä tai suolaliuoksesta (väkevöity NaCl-liuos) haihduttamalla aurinko. Lisäksi se löytyy luonnosta mineraalista nimeltä Halite.

Natriumkloridia käytetään enemmän kuin mitä tahansa muuta ainetta epäorgaanisten kemiallisten yhdisteiden valmistuksessa. Tämän aineen kulutus maailmassa on noin 150 miljoonaa tonnia vuodessa. Natriumkloridia käytetään pääasiassa muiden epäorgaanisten kemiallisten yhdisteiden, kuten kloorikaasun, natriumhydroksidin, metallisen natriumin, vetykaasun ja natriumkarbonaatin, tuottamiseen. Sitä käytetään myös jään ja lumen sulattamiseen moottoriteillä ja teillä.