Kovalenttinen joukkovelkakirjaesimerkki
Kemia / / July 04, 2021
Kovalenttisidos on se, jossa kaksi atomia yhdistyvät jakamalla elektroninsa, täydentämään Octet-sääntöjäsi.
Kovalenttisen joukkovelkakirjan historia
1900-luvun alussa kemistit alkoivat ymmärtää, miten ja miksi molekyylejä muodostui. Ensimmäinen merkittävä läpimurto tuli ehdotuksella Gilbert Lewis mistä kemiallisen sidoksen muodostuminen merkitsee sitä atomit jakavat elektroneja. Lewis kuvasi kemiallisen sidoksen muodostumista vedyssä seuraavasti:
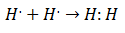
Tämäntyyppinen elektronipari on esimerkki kovalenttisesta sidoksesta, sidoksesta, johon kaksi atomia jakavat kaksi elektronia. Kovalentit yhdisteet He ovat sitä sisältävät vain kovalenttisia sidoksia.
Elektronit kovalenttisessa sidoksessa
Yksinkertaisuuden vuoksi jaettu elektronipari on usein edustettuna yksi rivi yhdistämällä elementtien symbolit. Siten vetymolekyylin kovalenttinen sidos kirjoitetaan H-H: ksi.
Kovalenttisessa sidoksessa jokaisen jaetun parin elektroni on kiinnostunut molempien atomien ytimistä. Tämä vetovoima pitää kaksi H-molekyylin atomia yhdessä.
2 ja se on vastuussa kovalenttisten sidosten muodostumisesta muissa molekyyleissä.Useiden elektronien atomien välisissä kovalenttisissa sidoksissa vain valenssielektronit osallistuvat, jotka ovat syrjäisimmät matalimmalla kiertoradalla. Yhdestä kolmeen heistä osallistuu liittoon.
Muut elektronit, jotka eivät osallistu sidokseen, kutsutaan Sitoutumattomat elektronittai jos järjestämme ne pareittain, Ilmaiset parit. Eli Valencia-elektronipareja, jotka eivät osallistu kovalenttisen joukkovelkakirjojen muodostamiseen.
Kovalenttinen joukkovelkakirjojen edustus
Rakenteet, joiden kanssa kovalenttiset yhdisteet ovat edustettuina, kuten H2 ja F2 tunnetaan nimellä Lewis-rakenteet. Lewis-rakenne on a kovalenttisen sidoksen esitys, jossa jaettujen elektronien pari jotka on merkitty viivoilla tai kahden atomin välisinä pisteinä, ja jakamattomat vapaat parit ilmoitetaan pisteinä pareiksi yksittäisissä atomeissa. Lewis-rakenteessa vain valenssielektronit näytetään, eivät sisäiset.
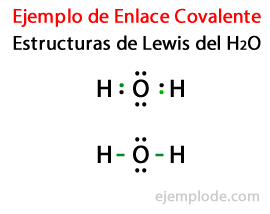
Kun otetaan huomioon vesimolekyylin H Lewisin rakenne2Tai pisteitä ensin kaikki vety- ja happiatomien valenssielektronit.
Toisessa tapauksessa linkki on merkitty viivalla. Ja vapaat parit, jotka ovat olemassa vain hapessa, pisteillä.
Oktetin sääntö
Näiden molekyylien, kuten veden H, muodostuminen2Tai kuvaa puhelua Octet-sääntö, ehdotti Lewis: Muu atomi kuin vety pyrkii muodostamaan sidoksia, kunnes se ympäröi itseään kahdeksan valenssielektroniaToisin sanoen kovalenttinen sidos muodostuu, kun kullekin yksittäiselle atomille ei ole tarpeeksi elektroneja oktettinsa täydentämiseksi.
Jakamalla elektroneja kovalenttiseen sidokseen, jokainen atomi täydentää oktettinsa. Vedyn osalta vaaditaan, että hankit heliumin elektronisen kokoonpanon, jossa on oltava yhteensä kaksi elektronia.
Oktetisääntö toimii pääasiassa jaksollisen taulukon toisen jakson tai rivin elementeille. Näillä elementeillä on alatasoja, joissa voi olla yhteensä kahdeksan elektronia.
Kun näiden alkuaineiden atomi muodostaa kovalenttisen yhdisteen, se saa Neon-jalokaasun elektronisen konfiguraation jakamalla elektroneja muiden atomien kanssa samassa yhdisteessä.
Kovalenttisten joukkovelkakirjojen tyypit
Atomit voivat muodostaa erityyppisiä kovalenttisia sidoksia: Sinkut, kaksinkertaiset tai kolminkertaiset.
Jonkin sisällä Yksinkertainen linkki, kaksi atomia on yhdistetty Elektronipari. Niitä esiintyy valtaosassa kovalentteja yhdisteitä, ja se on tämän sidoksen alkeellisin muoto.
Monissa yhdisteissä Tuplalinkit, toisin sanoen kun kaksi atomia jakaa Kaksi paria elektroneja. Jos kahdella atomilla on kaksi elektroniparia, kovalenttista sidosta kutsutaan kaksoissidokseksi. Näitä sidoksia löytyy molekyyleistä, kuten hiilidioksidista (CO2) ja eteeni (C.2H4).

A Kolmoislinkki syntyy, kun kaksi atomia jakaa Kolme paria elektroneja, kuten typpi-N-molekyylissä2, asetyleeni C-molekyyli2H2.

Useat sidokset ovat lyhyempiä kuin yksittäiset kovalenttiset sidokset. Linkin pituus on määritelty kahden yhdistetyn atomin ytimen välinen etäisyys molekyylin kovalenttisella sidoksella.
Erot kovalenttisten ja ionisten yhdisteiden välillä
Ionisten ja kovalenttisten yhdisteiden yleisissä fysikaalisissa ominaisuuksissa on huomattavia eroja johtuen siitä, että niiden sidokset ovat luonteeltaan erilaisia.
vuonna Kovalentit yhdisteet olla olemassa kahden tyyppisiä houkuttelevia voimia; yksi heistä on joka pitää molekyylin atomit yhdessä. Tämän vetovoiman kvantitatiivinen mitta on sitova energia. Toinen vetovoima toimii täydellisten molekyylien välillä, ja sitä kutsutaan Molekyylien välinen voima. Koska molekyylien väliset voimat ovat yleensä heikompia kuin voimat, jotka pitävät molekyylin atomeja yhdessä, kovalenttisen yhdisteen molekyylit sitoutuvat vähemmän voimalla.
Rauhassa, kovalenttiset yhdisteet ovat melkein aina matalasti sulavia kaasuja, nesteitä tai kiinteitä aineitan. Toisaalta sähköstaattiset voimat, jotka pitävät ioneja yhdessä ionisessa yhdisteessä ne ovat yleensä erittäin vahvojaniin, että ioniset yhdisteet ovat kiinteitä huoneenlämpötilassa ja niillä on korkeat sulamispisteet. Monet ioniset yhdisteet ovat vesiliukoisia, ja niiden vesiliuokset johtavat sähköä, koska nämä yhdisteet ovat vahvoja elektrolyyttejä.
Suurin osa kovalenttiset yhdisteet ovat veteen liukenemattomiaja jos ne liukenevat, sen vesiliuokset kuten tavallista ne eivät johda sähköä koska nämä yhdisteet eivät ole elektrolyyttejä. Sulatut ioniyhdisteet johtavat sähköä, koska ne sisältävät vapaasti liikkuvia kationeja ja anioneja; nestemäiset tai sulatetut kovalenttiset yhdisteet eivät johda sähköä, koska läsnä ei ole ioneja.
Esimerkkejä kovalenttisesti sitoutuneista yhdisteistä
- Asetyleeni C2H2
- Metaani CH4
- Etaani C2H6
- Propaani C3H8
- Butaani C4H10
- Bentseeni C6H6
- Tolueeni C7H8
- Metyylialkoholi CH3vai niin
- Etyylialkoholi C2H5vai niin
- Propyylialkoholi C3H7vai niin
- Metyylieetteri CH3OCH3
- Metyylietyylieetteri C2H5OCH3
- Etyylieetteri C2H5OC2H5
- Muurahaishappo HCOOH
- Etikkahappo CH3COOH
- Propionihappo C2H5COOH
- Voihappo C3H7COOH
- Hiilidioksidi CO2
- Hiilimonoksidi CO
- Molekyylityppi N2
- Molekyylivety H2



