Esimerkki kemiallisista ilmiöistä
Kemia / / July 04, 2021
Kemia tutkii aineen komponentteja, niiden muodostamia yhdisteitä ja niiden mahdollisia yhdistelmiä näistä yhdistelmistä johtuvat tuotteet ja niiden rakenne sekä ilmiöt, jotka tuottavat, kiihdyttävät tai hidastavat niitä muutokset. A Kemiallinen ilmiö on sellainen, jossa kahdelle tai useammalle aineelle tapahtuu muutos, joka muuttaa niiden sisäistä rakennetta, jolloin syntyy yksi, kaksi tai useampia aineita, eroaa alkuperäisestä aineesta.
Toisin kuin fyysiset ilmiöt, joissa esineiden joitain ominaisuuksia muutetaan, mutta ne ovat aina sama aine tai yhdiste, fysikaalisissa ilmiöissä aineiden rakenne muuttuu, jolloin seurauksena muut aineet poikkeavat alkuperäiset. Toisin sanoen kaikki kemialliset ilmiöt ovat kemiallisia reaktioita, jotka johtavat yhteen tai useampaan aineeseen, jotka eroavat molekyylisesti alkuperäisestä aineesta tai aineista.
Kemiallisten ilmiöiden tyypit:
Kemialliset ilmiöt voidaan luokitella tuloksen suhteen seuraavasti:
Synteesi
Kaksi tai useampia yhdisteitä yhdistyvät muodostaen monimutkaisemman yhdisteen.
Hajoaminen
Monimutkainen yhdiste hajoaa muodostaen yksinkertaisempia molekyylejä.
Siirtymä
Yksi reagoivien molekyylien alkuaineista tai radikaaleista tulee osaksi toista molekyyliä, joiden kanssa se reagoi.
Kaksinkertainen vieritys
Reagoivat molekyylit vaihtavat elementin tai radikaalin, jolloin syntyy kaksi erilaista molekyyliä, joihin ne reagoivat.
Nyt reaktioita kemiallisina ilmiöinä voidaan mainita seuraavat:
Hapetus
Hapetus on reaktio, jossa happi yhdistyy toisen alkuaineen kanssa, jolloin metallien tapauksessa saadaan oksidi ja oksihappo, jos se yhdistyy ei-metallisten alkuaineiden kanssa. Reaktio on hidasta eikä materiaalin lämpötila nouse.

Palaminen
Palaminen on nopea hapettumisen muoto, jossa myös valoa ja lämpöä vapautuu, toisin sanoen se on eksogeeninen reaktio.
Alkalisointi
Se tapahtuu, kun metalli yhdistyy hydroksyyliradikaaliin (radikaali -OH-muodon kanssa).
Happamoituminen
Se on, kun ei-metallinen alkuaine yhdistetään vedyn kanssa
Neutralointi
Se on hydroksidin ja hapon yhdistelmä, mikä johtaa veden ja suolan muodostumiseen.
Vähennys
Hapen poistaminen oksidista on puhtaan metallin saaminen reaktiolla vedyn kanssa haposta.
Ionisaatio
Liuotettaessa suolaa veteen, sen muodostavat alkuaineet erotetaan atomeiksi sähkövarauksilla, jotka voivat olla positiivisia (kationi) tai negatiivisia (anioni). Tämän tyyppisiä liuoksia kutsutaan elektrolyyteiksi.
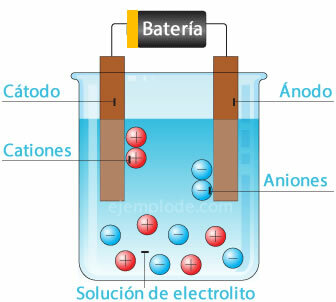
Elektrolyysi
Kun sähkövirta johdetaan elektrolyytin läpi, sähkö aiheuttaa atomien irtoamisen vedestä. vetyioni positiivisella varauksella menemällä negatiiviseen napaan (katodi) ja happi negatiivisella varauksella menemällä napaan positiivinen (anodi). Kun elektrolyysi suoritetaan hapossa, yksi vaikutuksista on metallielementin syrjäyttäminen anodiin.
Katalyysi
Kaksi ainetta, joka ei reagoi tai reagoi hyvin hitaasti, voi reagoida erittäin nopeasti kolmannen aineen läsnä ollessa, joka ei muutu ennen lääkettä tai sen aikana reaktio. Tämän tyyppistä ainetta kutsutaan katalyyteiksi.
Käyminen
Se on kemiallisen muutoksen saaminen, erityisesti orgaanisissa yhdisteissä, bakteerien vaikutuksesta.
Esimerkki kemiallisista ilmiöistä:
1. Maalaamaton grilli joutuu kosketuksiin ilman ja veden hapen kanssa ja alkaa näyttää ruostetta (hapettumista)
2. Puun tuominen lähelle tulta aiheuttaa sen palamisen, mikä aiheuttaa joitain sen muodostavista hiilimolekyyleistä sekoitetaan nopeasti hapen kanssa vapauttaen hiilidioksidia, jättäen palaneen puun ja noken jäämiksi (palaminen)
3. Ruoan hajoaminen johtuu bakteerien ruoansulatuskanavasta, joka muuttaa komponenttien kemiallista rakennetta. (Käyminen).
4. Auton akku tuottaa sähköä reaktiolla elektrolyytin ja metallikennojen välillä, joiden kanssa se muodostuu, aiheuttaen sähköä tuottavien ionien vapautumisen. Sen lataamiseksi nykyinen virtaus suorittaa elektrolyyttisen toiminnan, joka palauttaa ionit levyihin.
5. Automoottorin tuottamat kaasut ovat vakaita ja tuskin hajoavat, kun ne ovat poistuneet moottorista ja saavuttaneet huoneen lämpötilan. Katalysaattori sisältää platinavaahdon, joka kuumennettaessa noin 500 ° C: seen anna kaasujen hajota yksinkertaisemmiksi yhdisteiksi ilman platinaa muutokset.
6. Liuottamalla suola veteen se hajoaa natrium- ja kloori-ioneiksi.
7. Hieronta, joka tapahtuu, kun sekoitat sitruunamehua ruokasoodaan, on neutralointireaktio.
8. Kun vuotamme, veri saa tummemman värin punasoluissa esiintyvän raudan hapettumisen vuoksi. Siksi laskimoveri on tummempaa ja valtimoveri kirkkaampaa.
9. Autojen osien kromipinnoitus käyttää elektrolyysiä kromin tallentamiseen kromattavaan metalliosaan.
10. Ruoansulatuksessa kemiallisena ilmiönä suolahapon vaikutus ruokaan on hajottaa kompleksiset molekyylit, jotka muodostavat ne, pienemmiksi molekyyleiksi, jotka voidaan helpommin imeytyä suolisto.