Boylen lakiesimerkki
Fysiikka / / July 04, 2021
Kun tutkitaan kaasujen ominaisuuksia, Robert Boyle, toisaalta ja Edme mariotteToisaalta, tietämättä tai tietämättä kokeitaan, he havaitsivat, että kaasuja voidaan puristaa ja että niiden tilavuus vaihtelee suhteessa siihen kohdistuvaan paineeseen.
Hänen tutkimuksensa ymmärtämiseksi meidän on pidettävä mielessä, että tässä kaasututkimuksessa on otettava huomioon kolme ominaisuutta: lämpötila, tilavuus ja paine.
Lämpötila: Se on lämpötila, josta kaasu löytyy kokeen olosuhteissa. Se voidaan ilmaista celsiusasteina (° C) tai Kelvin-asteina tai absoluuttisena nollana (° K). Boylen lain tapauksessa lämpötilan katsotaan vaihtelevan eli pysyvän vakiona.
Tilavuus: Se on tila, jonka kaasu vie suljetussa astiassa. Ensinnäkin kaasun tilavuus on säiliön tilavuus. Esityksen vuoksi astian katsotaan olevan suljettu ja männällä, kuten ruiskulla.
Paine: Se on paine, joka kaasulla on männän läpi. Suljetussa astiassa, johon mäntä asetetaan kanneksi, ilman painetta, sen katsotaan olevan ilmakehän paineessa (1 at).
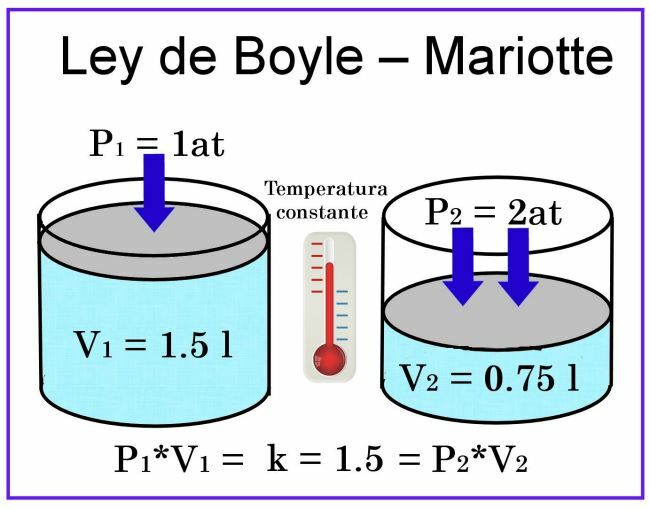
Boylen ja Mariotten havainnoissa lämpötilan katsotaan olevan vakio, joten se ei vaikuta mittaukseen.
Tilavuuden suhteen, jos otetaan huomioon esimerkiksi sylinterimäinen astia, jonka tilavuus on 1 litra, ja sen kansi on mäntä liu'uttamalla, kun asetat sen peittämään ilmalla täytetyn astian, paine on 1 at, kun taas tilavuus on 1 litraa. Jos mäntään kohdistetaan 2 ilmakehän paine, kaasun tilavuus pienenee puoleen eli 0,5 litraan tai 500 ml: aan. Jos paine nousee 4 ilmakehään, tilavuus pienenee neljäsosaan eli 0,25 litraan tai 250 ml: aan.
Näiden havaintojen perusteella kutsu ilmoitettiin Boylen laki: Vakiolämpötilassa kaasun tilavuus on kääntäen verrannollinen siihen kohdistuvaan paineeseen.
Tämä tarkoittaa, että kun paine kasvaa, tilavuus pienenee ja kun paine laskee, tilavuus kasvaa.
Tämä johtaa siihen, että kaasun paineen ja sen tilavuuden välillä on suhde, joka vaihtelee yksi komponenteista, toinen vaihtelee samassa suhteessa, suhde pysyy vakiona sanoa:
P * V = k
P = paine
V = Tilavuus
k = paineen ja tilavuuden suhteen vakio
Tämän ymmärtämiseksi oletetaan, että meillä on 2,5 litran säiliö, joka on täynnä ilmaa ja korkin männän paine on 1,5 °. Joten suhteesi vakio on:
P * V = k = (2,5) (1,5) = 3,75
Jos nostamme nyt paineen 3 ilmakehään, jaamme k paineella P, ja meillä on:
k / P = V
3,75 / 3 = 1,25 litraa
Kuten näemme, kaksinkertaista painetta käytettäessä tilavuus on puolet alkuperäisestä ja paine-tilavuussuhteen vakio säilyy. Tämä ilmaistaan seuraavasti:
V1P1 = V2P2 = k
Toisin sanoen tilavuuden tulo 1 kertaa paine 1 on yhtä suuri kuin tilavuus 2 kertaa paine 2, ja tämä suhde pysyy vakiona.
Esimerkkejä Boyle-Mariotte-laista
Esimerkki 1. Laske tilavuus, jonka kaasu käyttää, joka on 3,75 litran tilavuus, 2 paineessa, jos siihen kohdistetaan 3,5 painetta.
V1 = 3,75 l
P1 = 2 klo
V2 = ?
P2 = 3,5 at
Kuten V1P1 = V2P2 = k
Laskemme järjestelmän vakion:
V1P1= k = (3,75) (2) = 7,5
Ratkaisemme V: lle2:
V2 = k / P2 = 7,5 / 3,5 = 2143 litraa
Esimerkki 2. Laske kaasuun kohdistettu paine, jos sen tilavuus on 2,25 litraa, jos sen tilavuus on 1,75 paineessa 3,25 litraa.
V1 = 3,25 l
P1 = 1,75 at
V2 = 2,25 l
P2 = ?
Laskemme järjestelmän vakion:
V1P1= k = (3,25) (1,75) = 5,6875
Ratkaisemme P: lle2:
P2 = k / V2 = 5,6875 / 2,25 = 2,53 at
Esimerkki 3. Laske kaasun alkuperäinen paine, jos käytettäessä 4,5 paineen painetta se on 1,4 litraa ja sen alkuperäinen tilavuus oli 2,2 litraa.
V1 = 2,2 l
P1 = ?
V2 = 1,4 l
P2 = 4,5 at
Laskemme järjestelmän vakion:
V2P2= k = (1,4) (4,5) = 6,3
Ratkaisemme P: lle2:
P1 = k / V1 = 6,3 / 2,2 = 2,863 at

