Määritelmä reaktionopeus
Sekalaista / / July 04, 2021
Kirjoittanut Florencia Ucha, helmikuussa. 2014
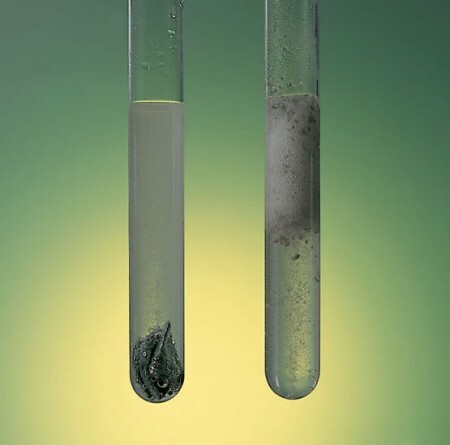 Käsite nopeus reaktio nimeää tietyssä reaktiossa muuttuneen aineen määrä tilavuusyksikköä ja aikaa kohti. Siten materiaalin, kuten raudan, reaktio on paljon hitaampaa ja kestää vuosia vertailu kanssa palaminen butaanikaasua tulipaloista, joka syntyy muutamassa sekunnissa.
Käsite nopeus reaktio nimeää tietyssä reaktiossa muuttuneen aineen määrä tilavuusyksikköä ja aikaa kohti. Siten materiaalin, kuten raudan, reaktio on paljon hitaampaa ja kestää vuosia vertailu kanssa palaminen butaanikaasua tulipaloista, joka syntyy muutamassa sekunnissa.
Sillä välin se on kemiallinen kinetiikka, kyseinen alue fysikaalinen kemia vastuussa opiskelusta nopeus reaktion nopeus ja tietyt vaihtelevat olosuhteet muuttavat materiaalin tai aineen reaktionopeutta ja myös molekyylitapahtumia, jotka tapahtuvat yleisessä reaktiossa. Sillä välin se on kemiallinen dynamiikka joka käsittelee erityyppisten reaktioiden nopeuksien alkuperän tutkimista.
On huomattava, että kemian tekniikka, ympäristötekniikka ja entsyymi soveltaa kemiallista kinetiikkaa prosesseissaan.
On useita tekijät jotka vaikuttavat reaktion nopeuteen ja että on tarpeen luetella, jotta tiedetään, miten ne vaikuttavat siihen ...
Luonto reaktion merkitys on ratkaiseva, koska on joitain reaktioita, jotka luonteeltaan voivat olla nopeampia kuin toiset ja päinvastoin. Reagoineiden lajien määrä, hiukkasten fyysinen tila ja
Toisaalta, sitä korkeampi pitoisuus nopeampi reaktionopeus.
Painepuolestaan vaikuttaa myös reaktionopeuteen. Siten kaasumaisten reaktioiden nopeus kasvaa merkittävästi paineen myötä, mikä on käytännössä sama kuin kaasun konsentraation lisääminen.
Järjestys reaktion vaikutus on myös sillä järjestyksellä, miten konsentraatio vaikuttaa kyseessä olevan reaktion nopeuteen.
Ja lopuksi lämpötilaon sen merkitys, koska suoritettaessa reaktiota erittäin korkeassa lämpötilassa se saa aikaan suuremman Energia ja siksi reaktion nopeus kasvaa aiheuttaen suurempia hiukkasten törmäyksiä.
Aiheet reaktionopeudessa

