10 exemples de mélanges de gaz
Divers / / July 04, 2021
Mélanges de substances gazeuses Ils sont parmi les plus faciles à réaliser, car il est très possible que des substances qui sont dans cet état d'agrégation soient mélangées. Par exemple: Mélange néon, argon et xénon, insecticide en aérosol, air et hélium.
Pratiquement tous les gaz peuvent être combinés à l'infini, bien sûr conditionnés par certains chimiques, physiques et fondamentalement liés aux aspects de sécurité des utilisateurs qui manipule. Comme les différents types de mélanges qui s'établissent entre substances, les mélanges de des gaz ils ont aussi des propriétés qui leur sont propres.
L'Etude de mélanges pétillants est généralement aussi utile que celle des gaz à l'état pur: la même connaissance de l'air qui est présent dans l'atmosphère serait impossible sans la connaissance des proportions et des comportements des gaz mélangés.
De cette façon, il est essentiel de connaître certains fonctionnalités des mélanges gazeux, telle que la propriété de pression partielle (celle exercée par chacun des gaz dans le mélange) et celui de la fraction molaire (rapport entre le nombre de moles d'un composant gazeux et celui du mélange total un soda). Les moles expriment la quantité de gaz dans le mélange.
La La loi de Dalton indique que la pression totale d'un mélange gazeux est égale à la somme des pressions partielles de chaque l'un des gaz individuels qui y participent (sous réserve que les gaz ne réagissent pas entre Oui). La pression partielle s'entend ici comme celle qu'exercerait chacun des gaz s'il ne se trouvait que dans le même récipient et dans les mêmes conditions de Température. A) Oui :
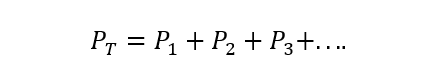
Où PT est la pression totale et P1, P2 Et P3 sont les pressions partielles des gaz hypothétiques 1, 2 et 3 dans le mélange gazeux.
En utilisant la loi de Dalton, une expression a été développée pour calculer le pression partielle d'un gaz dans un mélange gazeux si l'on connaît sa pression totale et sa fraction molaire.
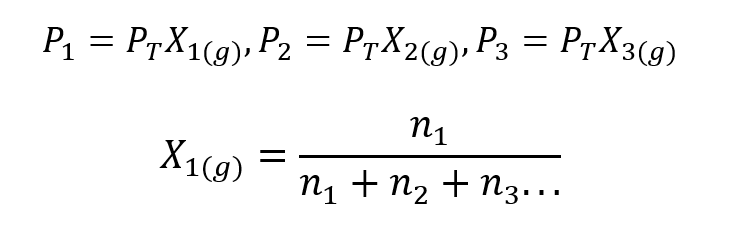
Où X1, X2 Oui X3 sont les fractions molaires des gaz hypothétiques 1, 2 et 3 dans le mélange gazeux, et m1, m2 Oui m3 sont les quantités de matière de chacun de ces gaz dans un même mélange.
Une des propriétés principales des composants dans les mélanges est la concentration, qui peut être exprimée dans différentes unités. Dans le cas des mélanges gazeux, la concentration de ses composants peut être exprimée en ppm (parties par million), unité rapportée à son volume. C'est-à-dire qu'une certaine quantité de ppm d'un composant dans un mélange gazeux est le rapport du volume de cette certaine quantité au volume de chaque million d'unités de mélange.
Il est important de noter que ppm d'un gaz dépendent de la température et de la pression du gaz. Pour cette raison, pour calculer les ppm d'un gaz, des conditions normales de pression et de température sont généralement utilisées. (CNPT), qui donnent un état normal à 0 degré Celsius de température, et 1013 hectopascals (1 bar) de Pression. Si ces conditions ne sont pas utilisées, vous devez spécifier celles qui seront utilisées.
Il peut vous servir :
Exemples de mélanges gazeux
La liste suivante contient des mélanges gazeux, en précisant les éléments qui apparaissent dans le mélange :
- Air (mélange de 21 % d'oxygène et 79 % d'azote, plus d'autres gaz en faible proportion)
- Cronigón (mélange de 99% d'argon et 1% d'oxygène)
- Trimix (mélange d'oxygène, d'azote et d'hélium)
- Mélange néon, argon et xénon
- Mélange de 85 % de méthane, 9 % d'éthane, 4 % de propane et 2 % de butane.
- Hexafluorure de soufre et air
- Insecticide en aérosol
- Air et hélium
- Nitrox (mélange d'air, enrichi en oxygène et azote)
Suivre avec:
