Comment se forment les hydroxydes? (avec exemples)
Divers / / July 04, 2021
Les hydroxydes résulter de la combinaison d'un oxyde métallique (aussi appelé oxydes basiques) Et l'eau. De cette façon, la composition des hydroxydes est donnée par trois éléments: l'oxygène, l'hydrogène et le métal en question. En combinaison, le métal agissez toujours comme cation et le groupe hydroxyde (OH–) agit comme un anion. Par exemple:
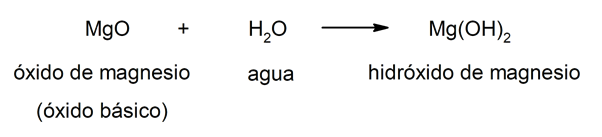
Les hydroxydes, en général, partagent un certain nombre de caractéristiques, comme présenter un goût amer et être caustique. De plus, ils sont généralement glissants au toucher et corrosifs. D'autre part, ils ont certaines propriétés de détergents et de savons. La plupart sont solubles dans l'eau et réagissent avec acides produire vous sortez.
Certaines caractéristiques, en revanche, sont propres à chaque type d'hydroxyde, comme celle de sodium (NaOH), qui absorbe l'eau, et mélangé à de la chaux vive (CaO) absorbe rapidement le dioxyde de carbone (CO2). Pour sa part, hydroxyde de calcium (Ca(OH)2) il est obtenu par réaction de l'oxyde de calcium avec l'eau et absorbe également le CO
2. Un autre exemple est le hydroxyde de fer (II) (Fe (OH)2), qui est un composé gélatineux et est pratiquement insoluble dans l'eau.Les hydroxydes sont aussi appelés bases ou alcalis, bien que ces termes aient été étendus également à d'autres substances à caractère alcalin et qui ne sont pas des hydroxydes.
A quoi servent les hydroxydes ?
Les applications des hydroxydes varient également entre les différents cas :
Nomenclatures
En plus de nommer d'autres types de composants chimiques, il existe différentes nomenclatures pour les hydroxydes :
Exemples d'hydroxydes
- Hydroxyde de plomb (II), Pb (OH)2, dihydroxyde de plomb.
- Hydroxyde de platine (IV), Pt (OH)4, tétrahydroxyde de platine.
- Hydroxyde vanadique, V (OH)4, tétrahydroxyde de vanadium.
- Hydroxyde ferreux, Fe (OH)2, dihydroxyde de fer.
- Hydroxyde de plomb (IV), Pb (OH)4, tétrahydroxyde de plomb.
- Hydroxyde d'argent, AgOH, hydroxyde d'argent.
- Hydroxyde de cobalt, Co (OH)2, dihydroxyde de cobalt.
- Hydroxyde de manganèse, Mn (OH)3, trihydroxyde de manganèse.
- Hydroxyde ferrique, Fe (OH)3, trihydroxyde de fer.
- Hydroxyde de cuivre, Cu (OH)2, dihydroxyde de cuivre.
- Hydroxyde d'aluminium, Al (OH)3, trihydroxyde d'aluminium.
- Hydroxyde de sodium, NaOH, hydroxyde de sodium.
- Hydroxyde de strontium, Sr (OH)2, dihydroxyde de strontium.
- Hydroxyde de magnésium, Mg (OH)2, dihydroxyde de magnésium.
- Hydroxyde d'ammonium, NH4OH, hydroxyde d'ammonium.
- Hydroxyde de cadmium, Cd (OH)2, le dihydroxyde de cadmium.
- Hydroxyde vanadique, V (OH)3, trihydroxyde de vanadium.
- Hydroxyde de mercure, Hg (OH)2, le dihydroxyde de mercure.
- Hydroxyde cuivreux, CuOH, hydroxyde de cuivre.
- Hydroxyde de lithium, LiOH, hydroxyde de lithium.
Les hydroxydes ont parfois noms communs donnée par ses utilisations plus conventionnelles: la soude est aussi appelée soude caustique, la potasse est appelée la potasse caustique, l'hydroxyde de calcium appelé eau de chaux ou chaux éteinte et l'hydroxyde de magnésium appelé lait de magnésie.
Suivre avec: