20 exemples d'effusion et de diffusion
Divers / / July 04, 2021
La la diffusion il s'agit d'un processus physique basé sur le flux de particules d'une espèce chimique d'une région de concentration plus élevée de cette espèce vers une région de concentration plus faible. Ce processus se produira jusqu'à ce que la concentration dans les deux régions soit la même.
La diffusion se produit généralement dans liquides Oui des gaz. Par exemple, lui arôme d'un repas En entrant dans une pièce, c'est une conséquence de la diffusion d'un mélange de deux gaz, c'est-à-dire le des particules alimentaires gazeuses (l'arôme) pénètrent dans la pièce, qui ne contenait initialement que air. De cette façon, elles diffusent jusqu'à ce que la concentration de ces particules soit la même à l'extérieur et à l'intérieur de la pièce.
Quelques caractéristiques d'une diffusion :
Exemples de diffusion

- Le parfum des fleurs dans un lieu clos.
- Un parfum qui se répand dans toute la pièce.
- Une personne parfumée qui entre dans une pièce et tout le monde peut sentir son parfum.
- La fumée dégagée par les voitures sur la route.
- Fumée des cheminées dans les maisons ou les usines.
- L'odeur d'un aliments décomposition à l'intérieur du réfrigérateur.
- L'odeur d'une bougie parfumée, d'un encens ou d'une allumette.
- La fumée d'une cigarette dans une pièce hermétique.
- Essences aromatiques.
- L'odeur d'un œuf pourri dans un récipient.
Effusion
La effusion est le processus par lequel un gaz s'échappe à l'extérieur d'un récipient par une petite ouverture ou fissure. Le taux d'effusion est directement proportionnel à la vitesse moyenne des particules de gaz.
Cela signifie que si un molécule de gaz lourd présente un épanchement, il le fera plus lentement qu'une molécule de gaz plus légère, auquel cas l'épanchement sera plus rapide. Par exemple: ballon dégonflé.
La loi de Graham
Si les conditions de pression et de température sont égales, le vitesse de diffusion et d'épanchement des gaz est inversement proportionnel aux racines carrées de leurs masses molaires.
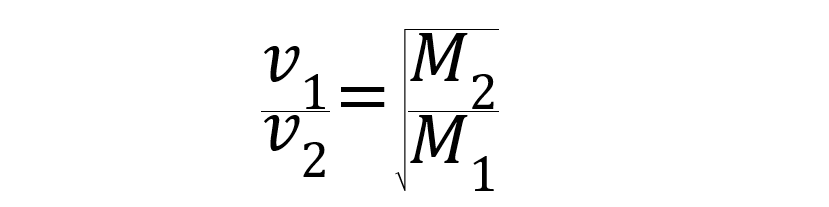
Étant v1 Oui v2 les vitesses des gaz 1 et 2 exprimées en mètres par seconde (m/s), et M1 Oui M2 les masses molaires des gaz 1 et 2 exprimées en kilogrammes par mole (kg/mole).
Exemples d'épanchement

- Appuyez sur le bouton d'un déodorant.
- Tournez un bouton de brûleur pour l'allumer ou l'éteindre.
- Une cartouche d'hélium avec une fuite.
- Une montgolfière qui présente une fuite.
- Sacs à dos motorisés.
- Les tubes à gaz des astronautes.
- Un ballon qui se dégonfle.
- Une flatulence.
- La séparation de l'uranium-238 en uranium-235-
- Une bouteille de gaz avec une petite fuite à travers laquelle ce gaz se déplace vers un autre compartiment ou vers l'extérieur.
Suivre avec:
