20 exemples d'acides
Divers / / July 04, 2021
Les acides constituent un groupe important de composants chimiques, très large. Les acides sont généralement définis comme des composés qui peuvent donner un ou plusieurs cations hydrogène (H+) à un autre composé, appelé base. Bien qu'en réalité, les acides soient définis selon plusieurs théories :
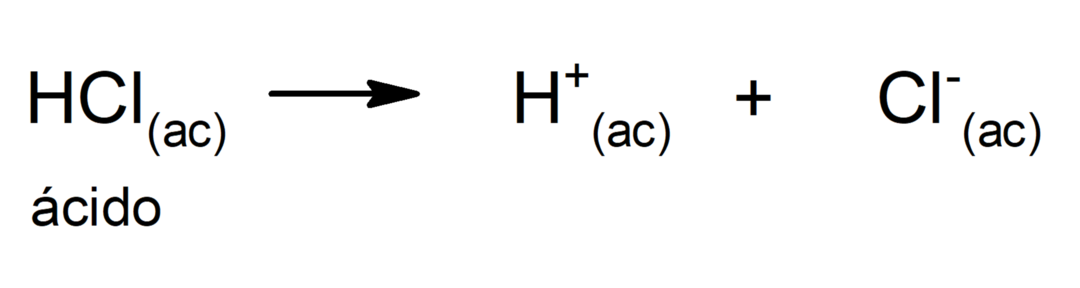 La limitation de cette théorie est que les acides ne sont définis qu'en solution aqueuse.
La limitation de cette théorie est que les acides ne sont définis qu'en solution aqueuse. 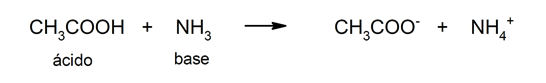

La propriété de libérer cations hydrogène est ce qui fait que les acides produisent des solutions de pH moins de 7. Les acides qui peuvent libérer plus d'un proton (en utilisant ce nom pour H+) sont appelés polyprotiques ou polyfonctionnels.
Propriétés acides
Concernant leur Propriétés, les acides peuvent être présentés comme liquides ou comment des gaz, plus rarement comme solide. Le goût acide que l'on peut reconnaître et qui caractérise ces composés, on le retrouve par exemple dans les agrumes, riches en acide citrique, ou le vinaigre, qui est une solution acide acétique. Ce sont des acides organiques.
exister
acides organiques et inorganiques; les plus forts sont généralement les inorganiques. De nombreux acides organiques remplissent des rôles biologiques importants. Parmi les inorganiques, il y en a un, l'acide chlorhydrique, qui joue un rôle très important dans le processus de digestion. Les acides nucléiques Ils sont également fondamentaux pour la vie, car ils sont à la base du matériel génétique de la cellules et contiennent la clé de la synthèse de protéine.La tendance à perdre des protons est ce qui détermine la force d'un acide.
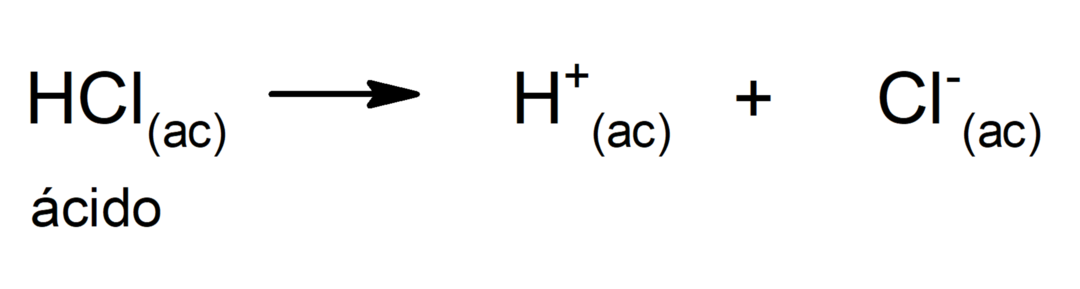
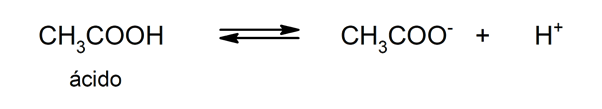
Utilisations des acides
Les acides ont de nombreuses utilisations, à la fois à l'échelle industrielle et domestique. Ils sont souvent utilisés comme additifs et conservateurs dans aliments, cosmétiques, boissons, etc. Certains solides acides sont utilisés comme catalyseurs (accélérateurs de réactions chimiques) dans l'industrie pétrochimique ou papetière.
Il existe également des acides utilisés comme désinfectants (acide phénique, acide salicylique). De plus, ils peuvent être utilisés comme électrolytes dans les batteries de voiture, comme c'est le cas avec l'acide sulfurique. Ce dernier acide fort est également fréquemment utilisé dans le traitement de minérauxC'est le cas de la production d'engrais à partir de phosphates naturels.
Il convient de préciser que certaines substances ne peuvent être solubilisées que dans des milieux acides, et que certaines réactions ne se produisent que dans de telles conditions. L'acide nitrique et l'ammoniac produisent du nitrate d'ammonium, également un engrais important pour les cultures.
Exemples d'acides
Vingt acides sont listés ci-dessous, à titre d'exemple :
- Acide perchlorique (HClO4). C'est un liquide acide fort un Température environnement, très oxydant.
- Acide nitrique (HNO3). C'est un acide fort et intensément oxydant, utilisé pour fabriquer certains explosifs et aussi des engrais azotés.
- Acide ascorbique (C6H8OU ALORS6). C'est la vitamine C, si nécessaire à la santé. C'est une substance protectrice pour ses effets antioxydants.
- Acide chlorhydrique (HCl(ca)). C'est le seul acide fort que le corps humain synthétise, un processus qui se produit spécifiquement dans l'estomac pour effectuer la dégradation de la aliments dans le processus digestif.
- Acide tartrique (C4H6OU ALORS6). C'est une poudre cristalline blanche, elle est utilisée dans la préparation de boissons effervescentes, dans les industries de la boulangerie, du vin et de la pharmacie. La crème de tartre que certaines recettes contiennent est l'acide tartrique.
- Acide fluorhydrique (HF(ca)). En raison de sa capacité à attaquer le verre, il est utilisé dans la sculpture et la gravure du cristal.
- Acide sulfurique (H2SW4). C'est un acide fort par excellence, il a d'innombrables applications dans divers les industries et les procédés de synthèse.
- Acide trifluoroacétique (C2HF3OU ALORS2). C'est un bon solvant pour beaucoup composés organiques.
- Acide phosphorique (H3Bon de commande4). Il est présent (en faibles concentrations) dans diverses boissons à base de cola. Il est considéré comme nocif pour la santé car il favorise la décalcification.
- Acide acétique (CH3COOH). C'est le composant principal du vinaigre. L'acidité qu'il crée en fait un conservateur alimentaire largement utilisé.
- Acide fluoroantimonique (SbHF6). C'est le superacide le plus fort connu, dépassant de 10 l'acidité de l'acide sulfurique pur.19.
- Acide chromique (H2CrO4). C'est une poudre rouge foncé, elle participe au processus de chromage. Il est également utilisé pour émailler les céramiques.
- Acide indoleacétique (C10H9NE PAS2). C'est le principal représentant des auxines, important dans les hormones de croissance de les plantes.
- Acide désoxyribonucléique (ADN). C'est celui qui détient la clé de la vie, puisqu'il constitue les gènes qui régissent la synthèse d'innombrables protéines.
- Acides tricarboxyliques. Ils comprennent un groupe d'acides carboxyliques qui ont trois groupes carboxyliques (-COOH). Acide citrique (C6H8OU ALORS7) C'est l'un d'entre eux.
- Acide formique (CH2OU ALORS2). C'est le plus simple des acides organiques. Une exposition prolongée à cet acide peut provoquer une insuffisance respiratoire et la mort.
- Acide gluconique (C6H12OU ALORS7). Les sels de cet acide sont largement utilisés dans les procédés de nettoyage de la verrerie.
- Acide lactique (C3H6OU ALORS3). C'est une partie importante des processus biochimiques.
- Acide benzoïque (C7H6OU ALORS2). C'est un acide à l'odeur caractéristique qui est largement utilisé pour conserver les aliments qui nécessitent une pH acide.
- Acide malique (C4H6OU ALORS5). Il est largement utilisé dans l'industrie pharmaceutique pour produire des laxatifs.
- Acide carbonique (H2CO3). Dans certains endroits, cela fait partie du processus de formation des grottes. Il est présent dans les boissons gazeuses.
