20 exemples d'alcanes
Divers / / July 04, 2021
Les alcanes ils sont une sorte de hydrocarbures dans lequel un nombre variable d'atomes de carbone sont reliés entre eux par des liaisons simples, comme un squelette, et chaque atome de carbone est lié à son tour à des atomes d'hydrogène, qui peuvent éventuellement être remplacés par d'autres atomes ou des groupes fonctionnels. Par exemple: chloroforme, méthane, octane.
La formule moléculaire des alcanes à chaîne linéaire ouverte est CnH2n + 2, où C représente le carbone, H représente l'hydrogène et n représente le nombre d'atomes de carbone. Les alcanes sont des hydrocarbures saturés, ce qui signifie qu'ils n'ont pas de doubles ou triples liaisons. Pour les nommer, vous utilisez le suffixe "-Ano" après avoir nommé la chaîne carbonée en utilisant le préfixe correspondant au nombre d'atomes de carbone (et-(2), pro-(3), but-(4), pen-(5), hex-(6), hep-(7), etc.).
Il peut vous servir :
Classification des alcanes
Dans les alcanes, ils sont généralement reconnus deux grands groupes: chaîne ouverte (appelée aussi acyclique) et chaîne fermée (ou cyclique).
Quand le composés à chaîne ouverte Ils ne présentent aucune substitution des hydrogènes qui accompagnent chaque atome de carbone, ils sont appelés alcanes linéaires: ce sont les alcanes les plus simples. Lorsqu'ils présentent une substitution de l'un de leurs hydrogènes par une ou plusieurs chaînes carbonées, ils sont appelés alcanes ramifiés. Les substituants les plus courants sont les groupes éthyle (CH3CH2-) et méthyle (CH3-).
De leur côté, il existe des composés à un seul cycle dans la molécule (monocyclique) et d'autres à plusieurs (polycyclique). Les alcanes cycliques ils peuvent être homocycliques (ils se forment avec l'intervention exclusive d'atomes de carbone) ou hétérocycliques (auquel participent d'autres atomes, par exemple l'oxygène ou le soufre).
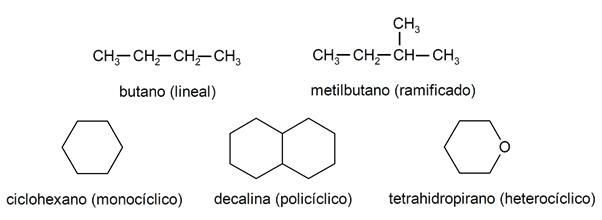
Propriétés physiques des alcanes
En général, propriétés physiques des alcanes sont conditionnés par la masse moléculaire (elle-même liée à la longueur de la chaîne carbonée). Ceux qui ont le plus petit nombre de carbones sont gazeux à Température l'environnement, ceux allant de 5 à 18 atomes de carbone sont liquides, et au-dessus de ce nombre sont solide (similaire à la cire).
Étant moins denses que l'eau, elles ont tendance à flotter dessus. En général, les alcanes sont insolubles dans l'eau et solubles dans les solvants organiques.
Le point de ébullition et de la fusion des alcanes dépend de leur masse moléculaire, c'est-à-dire de la longueur de la chaîne carbonée, bien qu'elles dépendent aussi plusieurs fois de la disposition spatiale des atomes. Les alcanes linéaires et cycliques ont des points d'ébullition plus élevés que les alcanes ramifiés.
Propriétés chimiques des alcanes
Les alcanes se caractérisent par composants chimiques de très mauvaise réactivité, c'est pourquoi on les appelle aussi « paraffines » (en latin, parum affinis signifie "faible affinité"). Ce sont des composés qui ont une énergie d'activation très élevée lorsqu'ils sont impliqués dans réactions chimiques. La réaction la plus importante que les alcanes peuvent subir est la combustion générant, en présence d'oxygène, de la chaleur, du dioxyde de carbone et de l'eau.
Les alcanes sont à la base d'une grande variété de réactions associées à processus industriels très important, étant les combustibles les plus traditionnels. Ils apparaissent également comme des produits finaux de processus biologiques tels que la fermentation méthanogène réalisée par certains micro-organismes.
Exemples d'alcanes
Voici quelques exemples d'alcanes (y compris certains linéaires et ramifiés bien connus) :
- Chloroforme (nom de fantaisie du trichlorométhane; CHCl3). Les vapeurs de cette substance étaient utilisées comme anesthésiques. Il a été abandonné à cette fin car il s'est avéré endommager organes importants, comme le foie ou les reins. Son utilisation aujourd'hui est principalement comme solvant ou liquide de refroidissement.
- Méthane (CH4). C'est l'alcane le plus simple de tous: il est composé d'un seul atome de carbone et de quatre atomes d'hydrogène. C'est un gaz qui se produit naturellement par la décomposition de différents substrats organiques et qui est le principal composant du gaz naturel. Ces derniers temps, il a été reconnu comme l'un des gaz qui contribuent le plus à ce que l'on appelle l'effet de serre.
- Octane (C8H18). C'est l'alcane à huit carbones et il est d'une grande importance car il détermine la qualité finale du naphta, qui est un mélanger de divers hydrocarbures. Cette qualité est mesurée par l'indice d'octane ou d'octane du carburant, qui prend comme référence un faiblement détonant (indice 100) et un fortement détonant (indice 0).
- Hexane (C6H14). C'est un solvant important, son inhalation doit être évitée car très toxique.
- Butane (C4H10). Avec le propane (C3H8), constituent ce que l'on appelle les gaz de pétrole liquéfiés (GPL), qui se forment dans des sacs à gaz au cours du processus d'extraction du pétrole. Actuellement, le remplacement de l'essence ou du diesel par le GPL comme carburant est encouragé car il est d'un hydrocarbure plus respectueux de l'environnement (il n'émet que du dioxyde de carbone et de l'eau lors de sa combustion).
- Icosano (C20H42). C'est l'alcane à vingt carbones (le préfixe 'ico' signifie vingt)
- Cyclopropane (C3H6). Autrefois, il était utilisé comme anesthésique
- n-heptane (C7H16). C'est celui qui est pris comme référence pour le point zéro de l'échelle d'octane de l'essence, ce qui serait le moins souhaitable, car il brûle de manière explosive. Il est obtenu à partir de la résine de certains les plantes.
- 3-éthyl-2,3-diméthylpentane (C9H20)
- 2-méthylbutane (C5H12)
- 3-chloro-4-n-propylheptane (C10H21Cl)
- 3,4,6-triméthylheptane (C10H22)
- 1-bromo-2-phényléthane (C8H9Br)
- 3-éthyl-4-méthylhexane (C9H18)
- 5-isopropyl-3-méthylnonane (C13H28)
- cubain (C8H8)
- 1-bromopropane (C3H7Br)
- 3-méthyl-5-n-propyloctane (C12H26)
- 5-n-butyl-4,7-diéthyldécane (C18H28)
- 3,3-diméthyldécane (C12H26)