100 exemples d'éléments chimiques
Divers / / November 13, 2021
Les éléments chimiques sont un type d'affaire qui, par aucune procédure ou réaction chimique ils peuvent être réduits ou décomposés en d'autres éléments plus simples. Pour cette raison, on peut dire qu'un élément est tout la matière faite par atomes de la même et unique classe, c'est-à-dire des atomes qui ont le même numéro atomique (nombre égal de protons), bien qu'ils aient une masse atomique différente. Par exemple: soufre, bore, chrome, étain.
La première définition d'un élément chimique a été introduite par Lavoisier dans le Traité Élémentaire de Chimie, en 1789. Au XVIIIe siècle, Lavoisier subdivise les substances simples en quatre groupes :
Tableau périodique des éléments
Aujourd'hui ils se connaissent 118 éléments chimiques. Ils sont tous rassemblés, classés et organisés en fonction de plusieurs de leurs propriétés dans un schéma graphique connu sous le nom de tableau périodique des éléments, qui a été créé à l'origine par le chimiste russe Dimitri Mendeleïev en 1869. Le tableau périodique est composé de 18 groupes (colonnes) et 7 périodes (lignes), dans lesquels se trouvent les éléments chimiques.
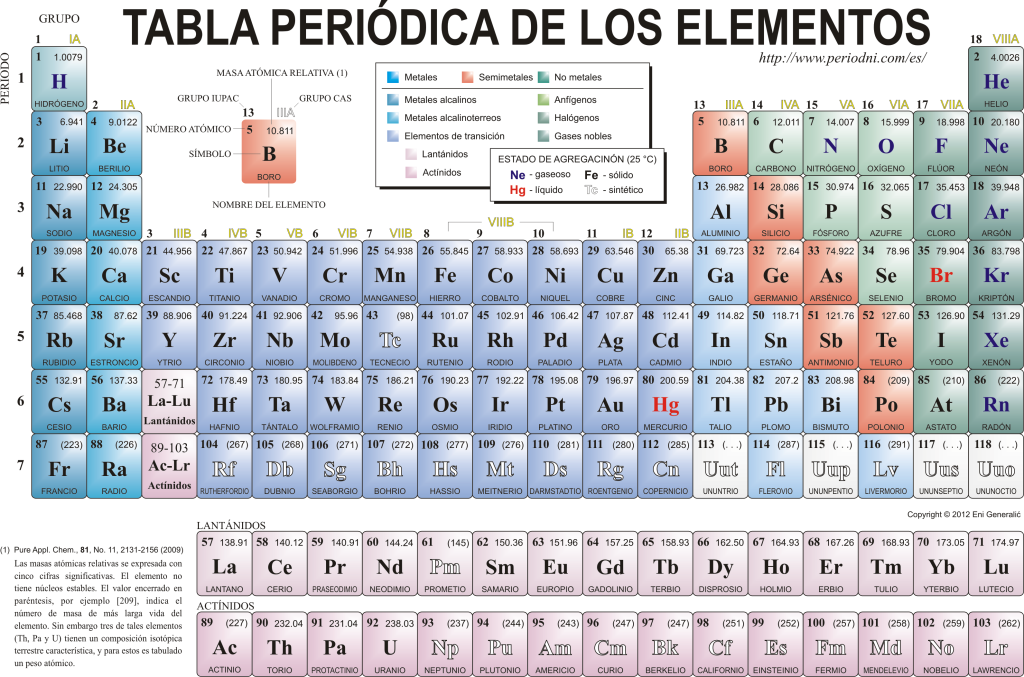
Les groupes principaux que l'on retrouve dans ce tableau sont :
Les métaux alcalins (Groupe 1), les métaux alcalino-terreux (Groupe 2), la famille du scandium, qui comprend les terres et les actinides (Groupe 3), la famille du titane (Groupe 4), la famille du vanadium (Groupe 5), la famille du chrome (Groupe 6), la famille du manganèse (Groupe 7), la famille du fer (Groupe 8), la famille du cobalt (Groupe 9), la famille du nickel (Groupe 10), la famille du cuivre (Groupe 11), la famille du zinc (Groupe 12), les éléments terre (Groupe 13), les éléments carbonides, dans ce groupe est le carbone, qui constitue la base de la vie sur Terre (Groupe 14), les éléments formateurs d'azote (Groupe 15), les éléments amphigénétiques, comprend l'oxygène, élément fondamental pour la respiration des êtres vivants (Groupe 16), éléments halogènes (Groupe 17) et gaz rares (Groupe 18).
Beaucoup de ces éléments ont isotopes stables ou radioactifs, c'est-à-dire qu'un même élément chimique, par exemple l'hydrogène (H), peut avoir plusieurs isotopes (1H, 2H, 3H). Cela signifie que chaque atome d'isotope a le même nombre de protons (ce qui implique qu'il appartient au même élément chimique) et un nombre différent de neutrons.
Certains isotopes ne sont pas stables (radioactifs), c'est-à-dire désintégrer dans un certain temps, émettant certaines particules (neutrons, photons, particules alpha, entre autres) et génèrent d'autres isotopes stables ou radioactifs. Les éléments chimiques ont des propriétés telles que le point de ébullition et celui de la fusion, électronégativité, densité et le rayon ionique, entre autres. Ces propriétés sont importantes car elles nous permettent de prédire son comportement, sa réactivité, etc.
Comment les éléments sont-ils présentés dans le tableau périodique ?
Chaque élément chimique est caractérisé par le Table périodique en utilisant une certaine symbologie. En premier lieu, au centre de chaque carré son symbole universel, qui consiste en un ou deux lettres (par convention, s'il y a deux lettres, la première est écrite en majuscule et la suivante en minuscule).
Au-dessus et à gauche apparaît en petits caractères su numéro atomique, qui est celui qui indique la quantité de protons que cet élément possède. Sous le symbole de l'élément, son nom apparaît et au-dessus, à gauche, son nom apparaît. masse atomique relatif. De plus, la couleur dans laquelle le symbole de l'élément est représenté signifie son état d'agrégation (selon la représentation utilisée dans chaque tableau périodique).
Les différents éléments présents rayons atomiques variables et, à mesure que le nombre de protons dans le noyau augmente, plus l'attraction que le noyau exerce sur les électrons est grande, de sorte que le rayon atomique a tendance à diminuer. Lorsque le rayon atomique est petit, les électrons situés au niveau le plus externe du nuage sont très attirés par le noyau, de sorte qu'ils n'abandonnent pas facilement. L'inverse se produit avec les éléments à rayons atomiques élevés: ils cèdent facilement leurs électrons externes.
Ainsi, le rayon atomique augmente de haut en bas lorsque nous parcourons les groupes du tableau périodique et diminue de gauche à droite lorsque nous parcourons leurs périodes.
Exemples d'éléments chimiques
| Élément chimique | symbole |
| Actinium | c.a. |
| Aluminium | Au |
| Américium | UN M |
| Antimoine | Sb |
| Argon | Ar |
| Arsenic | As |
| Astat | À |
| Soufre | S |
| Baryum | Ba |
| Béryllium | Être |
| Berkélium | Noir |
| Bismuth | Bi |
| Bohrio | Bh |
| Bore | B |
| Brome | Br |
| Cadmium | CD |
| Calcium | CA |
| Californie | Cf. |
| Carbone | C |
| Cérium | CE |
| Césium | Cs |
| Chlore | Cl |
| Cobalt | Co |
| Cuivre | Cu |
| Chrome | Cr |
| Curium | Cm |
| Darmstadio | DS |
| Dysprosium | Dy |
| Dubnium | DB |
| Einsteinium | Il est |
| Erbium | Euh |
| Scandium | Sc |
| Étain | Sn |
| Strontium | m |
| Europium | UE |
| Fermium | FM |
| Fluor | F |
| Correspondre | P |
| François | Fr |
| Gadolinium | Dieu |
| Gallium | Géorgie |
| Germanium | Gé |
| Hafnium | Hf |
| Hassio | hs |
| Hélium | j'ai |
| Hydrogène | H |
| Fer | Foi |
| Holmium | Ho |
| Indien | Dans |
| Iode | je |
| Iridium | Aller |
| Ytterbium | Yb |
| Yttrium | Oui |
| Krypton | Kr |
| Lanthane | La |
| Laurent | G / D |
| Lithium | Li |
| Lutécium | lun |
| Magnésium | mg |
| Manganèse | Mn |
| Meitnerius | Mont |
| Mendélévie | Maryland |
| Mercure | Hg |
| Molybdène | Mo |
| Néodyme | N / A |
| Néon | Ne |
| Neptunium | Np |
| Niobium | Nb |
| Nickel | Ni |
| Azote | N |
| Nobelio | Pas |
| Or | Au |
| Osmium | Toi |
| Oxygène | OU ALORS |
| Palladium | PS |
| Argent | Ag |
| Platine | pt |
| Plomb | Pb |
| Plutonium | Pu |
| Polonium | Pô |
| Potassium | K |
| Praséodyme | Pr |
| Promettre | après-midi |
| Protactinium | Pennsylvanie |
| Radio | Ra |
| Radon | Rn |
| Rhénium | Ré |
| Rhodié | Rhésus |
| Rubidium | Rb |
| Ruthénium | Ru |
| Rutherfordio | Rf |
| Samarium | vous |
| Seaborgio | Sg |
| Sélénium | je connais |
| Silicium | Oui |
| Sodium | N / A |
| Thallium | Tl |
| Tantale | Ta |
| Technétium | Tc |
| Tellure | Thé |
| Terbium | To |
| Titane | Toi |
| Thorium | E |
| Thulium | Tm |
| Copernic | Cn |
| Livermorio | Niv |
| Roentgenio | Rg |
| Ununoctium | Uuo |
| Ununpentium | Uup |
| Flerovio | Fl |
| Ununseptio | Uus |
| Ununtrium | Uut |
| Uranium | OU ALORS |
| Vanadium | V |
| Tungstène | W |
| Xénon | Xe |
| Zinc | Zn |
| Zirconium | Zr |

Suivre avec: